
La industria farmacéutica china ha experimentado un crecimiento sustancial desde su entrada en la Organización Mundial del Comercio (OMC). En 2021, China tendrá una cuota del 12% del mercado farmacéutico mundial, lo que la convierte en el segundo mayor contribuyente. Según la Agencia de Noticias Xinhua, el mercado farmacéutico chino generará 708.750 millones de yuanes en 2021, mientras que las empresas farmacéuticas nacionales chinas acumularán 502.000 millones de dólares de beneficios.
Como sabrá, la Administración Nacional de Productos Médicos (NMPA), la autoridad sanitaria de China, ha comenzado a aceptar solicitudes de autorización de comercialización (MA) en formato eCTD, así como solicitudes de ensayos clínicos (CTA), lo que abre la puerta a nuevas oportunidades. Sin embargo, esto también plantea una serie de retos.
En este blog examinamos el mundo de la presentación electrónica de documentos técnicos comunes (eCTD), que se está convirtiendo rápidamente en el método de presentación de documentos más utilizado en la industria farmacéutica.
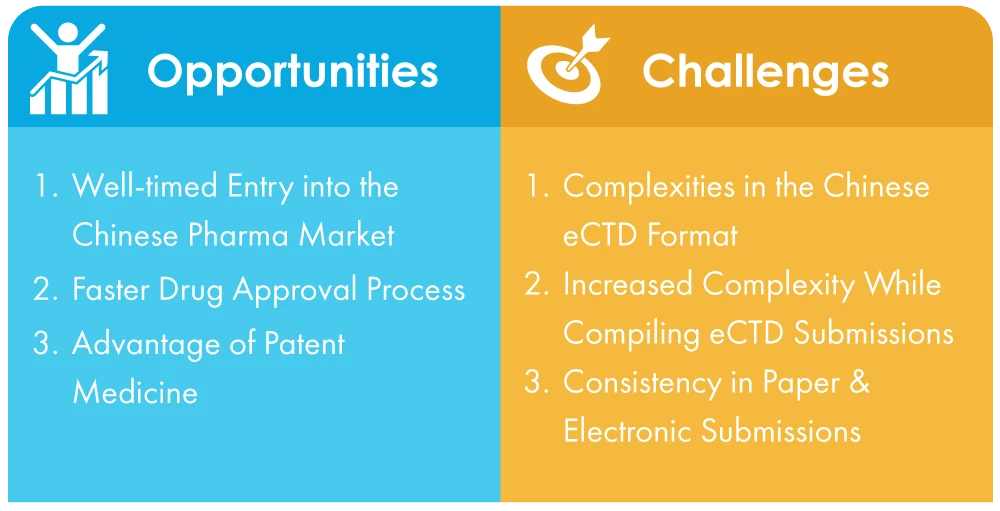
Retos a los que se enfrentan las empresas en China para adaptarse a la presentación obligatoria de eCTD
- Complejidades del formato eCTD chino: A diferencia de la norma universal, que es bastante sencilla, el formato eCTD chino es complicado y puede resultar difícil de pasar para las empresas que no estén familiarizadas con el proceso. Esto puede provocar contratiempos a la hora de presentar las credenciales esenciales.
- Mayor complejidad en la compilación de presentaciones eCTD: NMPA, la autoridad sanitaria de China, ha implementado nuevas normas y reglamentos para apoyar la transición a las presentaciones electrónicas, pero se espera que las empresas sigan navegando por un entorno complejo y dinámico. Esto puede suponer un mayor desafío para aquellas empresas que no tienen presencia local o un conocimiento profundo del ecosistema regulatorio de China.
- Apoyo multilingüe en las presentaciones en papel y electrónicas: Los documentos deben presentarse en mandarín con versiones en inglés como referencia, lo que puede ser una tarea difícil para las empresas que no tienen afiliaciones con traductores de idiomas cualificados.
Oportunidades en la transición de la presentación en papel a la presentación sin papel
- Entrada oportuna en el mercado farmacéutico chino: La entrada en el mercado chino se ha hecho más cómoda gracias a las reformas transformadoras y las actualizaciones de las políticas aplicadas. Uno de los cambios clave es la adopción de la presentación electrónica de solicitudes, que agiliza el proceso y elimina muchas de las dificultades a las que antes se enfrentaban las empresas. Este es un testimonio del compromiso de China de promover los ajustes estructurales, las transformaciones de los procedimientos y el crecimiento general del mercado.
- Proceso de aprobación de medicamentos más rápido: Ahora que las solicitudes se han convertido en electrónicas, el proceso de aprobación de medicamentos será mucho más rápido y, por tanto, el proceso de comercialización de medicamentos será más fluido y rápido. Con el tiempo, esto ayudará a las grandes empresas farmacéuticas a aumentar aún más la cuota de China en el mercado farmacéutico mundial.
- Ventajas de los medicamentos patentados: El medicamento patentado es el segundo segmento de productos con mayores márgenes de beneficio. Sin embargo, la fabricación de medicamentos originarios conlleva largos periodos de retorno, costes de I+D muy elevados y periodos de I+D prolongados. Con la implantación de la presentación electrónica de solicitudes, todos estos obstáculos pueden superarse. A partir de 2022, las empresas extranjeras seguirán siendo las principales participantes en este mercado. Por lo tanto, se trata de un nicho de mercado para dirigirse a este segmento.
¿Cómo estar preparado para esta nueva implantación en China?
La transición al envío obligatorio de documentos eCTD en China ofrece numerosas oportunidades a las empresas que desean seguir siendo competitivas en el mayor mercado farmacéutico del mundo. Al asociarse con el experto adecuado, las empresas pueden navegar por el panorama normativo en constante evolución con facilidad y confianza. Para mantenerse a la vanguardia, es fundamental contar con una filial con presencia local y que conozca la normativa de la HA. Freyr SUBMIT PRO, un software de publicación y envío de documentos, ayuda a los fabricantes a entrar con facilidad en el mercado farmacéutico chino. Para obtener más información sobre la herramienta, solicite una demostración.









