
A la mayoría de las organizaciones dedicadas a las ciencias de la vida les resulta difícil optimizar su proceso de presentación de solicitudes reglamentarias debido a los frecuentes cambios en las directrices de presentación. Según un análisis reciente realizado por la Administración de Alimentos y Medicamentos de los Estados Unidos (USFDA), el 32 % de las solicitudes con datos de estudios presentaban problemas críticos de conformidad de los datos. El proceso requiere un amplio conocimiento de la colaboración entre las partes interesadas internas y externas. Dentro de la organización, los departamentos de fabricación, investigación y desarrollo, investigación clínica/no clínica, QA, marketing y ventas deben trabajar en armonía para acelerar el proceso de aprobación desde el desarrollo inicial hasta la comercialización del medicamento. El Asuntos Regulatorios y las autoridades sanitarias (HA) mantienen una comunicación constante para garantizar y evaluar la seguridad y la eficacia de los medicamentos para uso humano. Veamos qué medidas preliminares deben tomar las organizaciones farmacéuticas para establecer la excelencia en las presentaciones reglamentarias:
Asignar y desplegar recursos para racionalizar, normalizar y agilizar el trabajo de presentación desorganizado.
Un especialista en presentaciones participa por contrato y puede comprender más de un (01) tipo de presentación al estar asociado con programas de desarrollo a lo largo de los años, ayudando a elaborar narrativas convincentes para el expediente. De este modo, se facilita a las organizaciones:
- Eliminar errores equilibrando la colaboración de las partes interesadas internas y externas
- Reducir el ciclo de revisión de HA del proceso de creación y aprobación de documentos
- Establecer presentaciones completas y conformes con los cambiantes requisitos normativos de los distintos mercados.
- Reconocer las presentaciones afectadas por una Autoridad Reguladora
- Estar al corriente del estado de la autoría, revisión y aprobación de los envíos.
- Mejora del protocolo de presentación actual
Simplificar la metodología de presentación de expedientes
La elaboración de un expediente es crucial cuando se trata de preparar presentaciones. Se observa que las solicitudes de licencia de productos biológicos (BLA) y las solicitudes de nuevos medicamentos (NDA) comprenden toneladas de páginas, lo que dificulta a los reguladores la comprensión de la narrativa del expediente. Disponer de una representación estructurada de una idea general puede ampliar la capacidad del equipo para preparar las presentaciones y de las agencias que las revisan.
El uso de módulos para racionalizar las presentaciones permite a los expertos analizar lo que debe incluirse en cada sección o módulo del expediente. Tal práctica facilita:
- Inicio temprano de la autoría acelerando la preparación de la presentación por parte de la organización.
- Utilización de los datos pertinentes necesarios para la autoría de las presentaciones
- Utilización de los recursos adecuados sin necesidad de redactar extensos documentos desde cero para cada presentación.
Trabajar en colaboración con las autoridades reguladoras
Toda organización debe celebrar reuniones periódicas con las autoridades sanitarias como práctica habitual durante la fase inicial de desarrollo del producto. De este modo se garantiza una revisión y respuesta oportunas, lo que agiliza la resolución de los comentarios por parte de la autoridad competente y, por consiguiente, el proceso de aprobación. No sólo crea una buena relación entre las organizaciones y la HA, sino que también ayuda a obtener claridad en una fase temprana de la planificación de la presentación.
Racionalizar contenidos y datos en el Sistema de Gestión Documental (SGD)
Se espera que un repositorio de contenido robusto gestione todos los datos de las distintas áreas funcionales, incluida la documentación y la información creada anteriormente. El contenido estructurado y el repositorio de datos proporcionan un acceso fluido a los documentos de diversas áreas funcionales sin ningún esfuerzo adicional ni necesidad de duplicarlos. Los documentos almacenados en el DMS se convierten en la única fuente de contacto para todas las partes interesadas internas (ciencia clínica, CMC, no clínica, farmacocinética, farmacodinámica, redacción médica y operaciones clínicas). Dicho contenido y datos pueden utilizarse para crear contenido local basado en los requisitos regionales. Optimización de las presentaciones reglamentarias mediante la gestión estructurada de contenidos y datos
Adoptar la tecnología y la automatización para reducir el trabajo repetitivo y los errores
Las organizaciones pueden hacer uso de la tecnología mediante la actualización automática y el control de calidad de las Tablas, Listados y Figuras (TLF) en el texto con respecto a los datos de origen para acelerar el proceso de documentación. De este modo, cada vez que se realizan cambios en las tablas de origen existentes, se actualiza el TLF en el texto. Esto ayuda a eliminar horas de trabajo totales, ahorrar tiempo en la ruta crítica y mejorar la precisión de los datos.
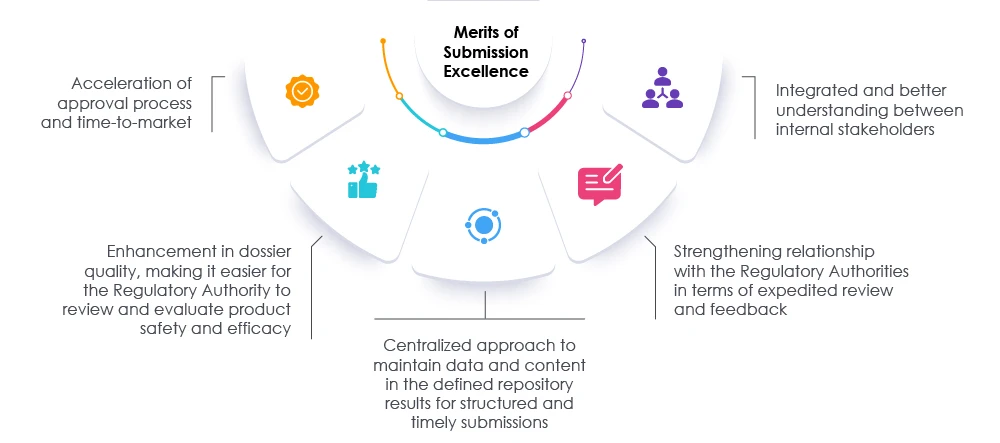
La adopción de medidas adecuadas, junto con revisiones oportunas de los expedientes y los datos, puede ayudar tanto a los reguladores como a las organizaciones a acelerar el proceso de presentación. Este enfoque acelera el tiempo de comercialización para satisfacer las necesidades de los pacientes y de la industria. Un socio regulatorio de probada eficacia puede ayudar a las organizaciones a replantearse, reevaluar y modificar los enfoques actuales para la preparación de las presentaciones. Nuestros expertos en Freyr facilitar el camino hacia la excelencia en las presentaciones reglamentarias aumentando la visibilidad en toda la organización y promoviendo el cumplimiento general, lo que permite a la organización tener éxito en el mercado actual de las ciencias de la vida. Consulte Freyr.









