
La idea de presentar solicitudes reglamentarias electrónicas para productos farmacéuticos es anterior a la propia herramienta eCTD. A finales de la década de 1980, laFDA Administración de Alimentos y Medicamentos) US y las agencias europeas exploraron iniciativas como CANDA (Solicitud de nuevos medicamentos asistida por ordenador). Estos primeros esfuerzos tenían por objeto mejorar la eficiencia y el acceso a los datos para los revisores.
Introduzca la Norma eCTD (2003):
La Conferencia Internacional sobre Armonización (ICH) dio un paso adelante en 2003 con una innovación revolucionaria: el estándar eCTD (documento técnico común electrónico). Este formato estandarizado se diseñó con el fin de establecer un lenguaje universal para las presentaciones electrónicas en todo el mundo.
La aparición de herramientas de eCTD:
Con la adopción de la norma eCTD, se disparó la demanda de herramientas especializadas en eCTD. Estas herramientas aportaron varias ventajas clave:
- Creación de contenidos racionalizada: Los usuarios pueden crear y organizar documentos de acuerdo con la estructura del eCTD.
- Validación robusta: las herramientas eCTD garantizaban que las presentaciones cumplían las especificaciones técnicas, evitando retrasos causados por errores de formato.
- Gestión eficaz del ciclo de vida: La gestión de las revisiones, el seguimiento de las versiones y el cumplimiento de la normativa resultan más sencillos.
Estas innovaciones revolucionaron el proceso de presentación reglamentaria, haciéndolo más eficaz y fiable.
Cómo el software Freyr automatiza la creación de eCTD
La avanzada solución de software Freyr , Freyr PRO, aborda estos retos automatizando aspectos clave de la creación de eCTD, lo que mejora la eficiencia y reduce los errores humanos.
Optimización de recursos: Al automatizar las tareas repetitivas, nuestro software libera valiosos recursos humanos. Los profesionales pueden centrarse en actividades más estratégicas y de mayor valor, como el análisis de datos, el desarrollo de estrategias normativas y la participación de las partes interesadas. Este cambio no sólo mejora la productividad, sino que también reduce los costes operativos, proporcionando un importante retorno de la inversión.
Minimización del riesgo de error humano: La automatización minimiza el riesgo de error humano al garantizar que los datos se transfieren con precisión y que los documentos tienen el formato correcto. Las comprobaciones de validación y los mecanismos de detección de errores integrados en el software mejoran aún más la calidad y la conformidad de las presentaciones reglamentarias. Esto reduce la necesidad de repetir el trabajo y ayuda a garantizar la aprobación a tiempo.
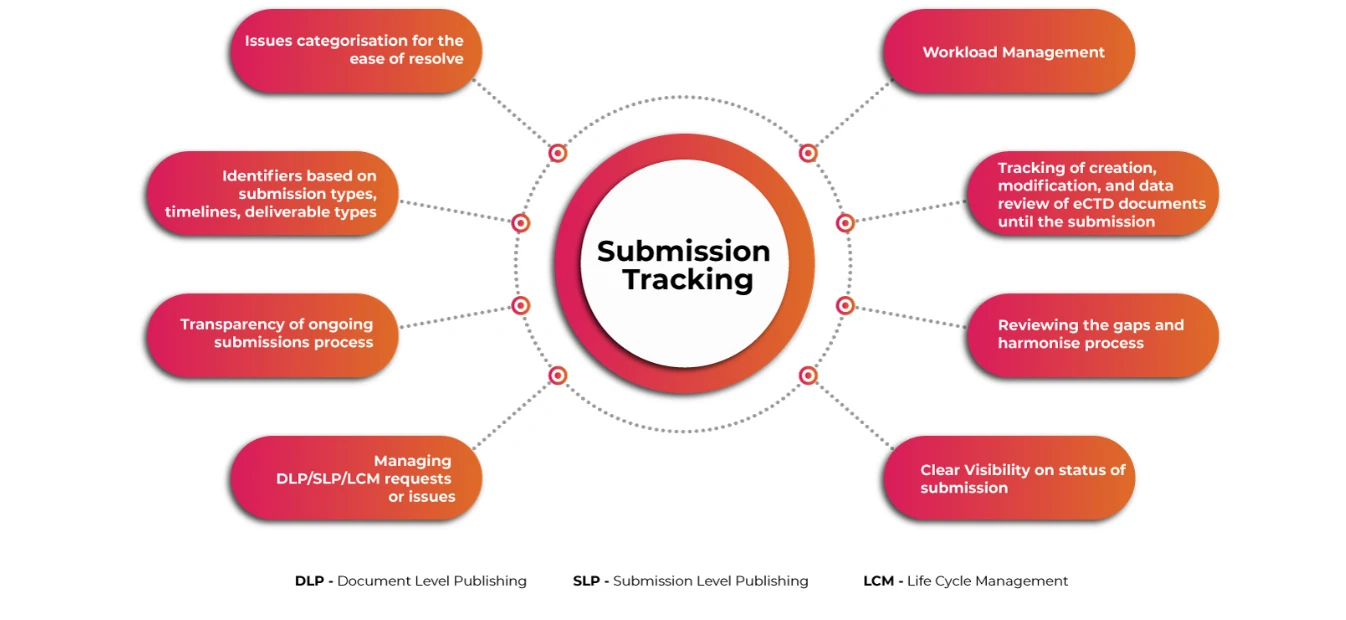
Rastreador de envíos para una visión completa de los envíos de eCTD
Un sistema automatizado fácil de usar para la planificación y el seguimiento de las complejas actividades globales de presentación de eCTD, la gestión del flujo de trabajo de las actividades y el almacenamiento y la gestión de las solicitudes reglamentarias y la información de presentación es imprescindible para garantizar que los solicitantes cumplan los retos asociados mucho antes de tiempo. La visibilidad de las operaciones de presentación y publicación a un nivel granular hace que todo el proceso de presentación sea más fluido y rápido.
Seguimiento de la presentación
La última actualización del eCTD
El cambio a eCTD 4.0 anuncia una mayor eficiencia y estandarización global en el proceso de aprobación de medicamentos farmacéuticos. Al prepararse para esta transición, su empresa podrá afrontar el cambio sin problemas y aprovechar las numerosas oportunidades era esta nueva era . Aunque el cambio a eCTD 4.0 puede plantear retos, estos se pueden superar con la dedicación y la determinación de todos los países implicados. Aunque será necesario realizar una inversión y un esfuerzo considerables, las importantes ventajas de eCTD 4.0 hacen que el esfuerzo merezca realmente la pena.
Revisión del proceso de presentación: eCTD 4.0 promete revolucionar la forma en que las empresas farmacéuticas presentan los datos de desarrollo de medicamentos a las autoridades sanitarias. Su objetivo es agilizar el proceso de presentación.
Calendario de implementación: La FDA aceptar nuevas solicitudes en formato eCTD 4.0 a partir de 2024. Las fases futuras abordarán las solicitudes existentes en v3.2.2 y la comunicación bidireccional.
Compatibilidad con versiones anteriores: eCTD 4.0 incluye compatibilidad con versiones anteriores, lo que permite reutilizar el ciclo de vida y los documentos de la versión 3.2.2. Esto simplifica la conversión de las aplicaciones de la versión 3.2.2 a eCTD 4.0. Esto simplifica la conversión de aplicaciones v3.2.2 a eCTD 4.0.
Criterios de validación: Están disponibles las especificaciones de los criterios de validación del eCTD 4.0. Estos criterios garantizan la calidad y exactitud de los envíos.
Cumplimiento mundial: En 2026, los organismos reguladores de todo el mundo podrán exigir el cumplimiento de las normas eCTD 4.0. Aunque actualmente es voluntario, su cumplimiento comenzará entre 2026 y 2029.
El futuro de la eCTD:
Debe dar la bienvenida a la IA y dinamizar su función reguladora, ya que aporta valor añadido a su negocio. Freya Fusion es una plataforma de gestión de información regulatoria (RIM) de vanguardia, impulsada por IA y nativa de la nube, que ofrece un rendimiento, una seguridad y una escalabilidad excepcionales, al tiempo que mantiene un estricto cumplimiento de las normas GxP. Mejorada con funciones avanzadasML automatización, Freya Fusion en el ámbito digital, proporcionando una funcionalidad superior y una experiencia de usuario excepcional. Los avances en IA de Freyr prometen módulos de producción y seguimiento de presentaciones, que incluyen funciones para la compilación, publicación y validación sin fisuras de las presentaciones reglamentarias, lo que garantiza un cumplimiento meticuloso de las directrices eCTD. Mantenerse a la vanguardia en el ámbito del cumplimiento normativo con SaaS impulsado por IA sin duda beneficiará a su empresa. Ya sea con un sistema de alerta temprana para los cambios normativos, la revisión y el análisis optimizados de los documentos normativos o el análisis predictivo para la gestión de riesgos, Freyr lo tiene todo cubierto. Reach conhello@freyrdigital.compara descubrir nuestras innovacionesML que optimizan las operaciones normativas en la industria médica.
Manténgase a la vanguardia con actualizaciones periódicas y avances tecnológicos. Asóciese con us optimizar sus operaciones normativas, aumentar la productividad y mejorar la calidad de las presentaciones. Solicite una demostración hoy mismo y experimente la combinación perfecta de experiencia y herramientas. Impulse su organización de buena a excelente. us hoy mismo.









