
En el dinámico mundo de los productos farmacéuticos, el papel de los datos del mundo real (RWD) y la evidencia del mundo real (RWE) es cada vez más importante. Estas herramientas sirven de puente entre el entorno controlado de los ensayos clínicos y las complejidades del mundo real de la atención al paciente. Varias empresas farmacéuticas han utilizado con éxito los RWD/RWE para respaldar sus solicitudes de autorización. Por ejemplo, en 2022, Bristol Myers Squibb recibió FDA para el uso de Opdivo (nivolumab) en combinación con Yervoy (ipilimumab) para el tratamiento de primera línea del melanoma metastásico, basándose en los datos RWE del ensayo CheckMate 151.
Con la reciente guía FDA de octubre de 2023 allanando el camino, es hora de que los innovadores farmacéuticos aprovechen el potencial de los datos del mundo real (RWD) y la evidencia del mundo real (RWE) para las presentaciones reglamentarias.
RWD/RWE puede utilizarse para apoyar una variedad de presentaciones reglamentarias, entre las que se incluyen:
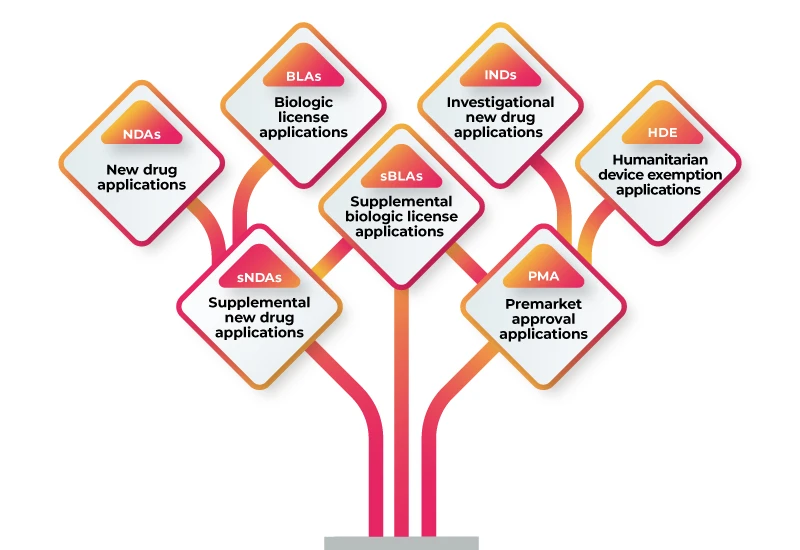
Para utilizar RWD/RWE en apoyo de su presentación reglamentaria, debe seguir estos pasos:
Paso 1: Defina su pregunta reglamentaria
Comience su viaje identificando la cuestión reglamentaria fundamental que pretende abordar. Ya se trate de la seguridad, la eficacia o el rendimiento en situaciones reales, la claridad en su objetivo es primordial.
Paso 2: Seleccionar fuentes RWD de calidad
La calidad es la clave aquí. Elija fuentes de RWD que se correlacionen directamente con su pregunta normativa. Las historias clínicas electrónicas, los datos de reclamaciones médicas y los registros de pacientes son recursos inestimables.
Paso 3: Diseñar un estudio sólido
El diseño de su estudio debe reflejar su pregunta reglamentaria y cumplir con las directrices reglamentarias. Su enfoque debe ajustarse a las expectativas FDA.
Paso 4: Analizar y generar RWE
Utilice métodos estadísticos sólidos para sus análisis. Una documentación clara es esencial para garantizar la transparencia y la credibilidad.
Paso 5: Interpretar y presentar los resultados
La objetividad es la piedra angular de la interpretación RWE. Su presentación debe adaptarse a su público, transmitiendo con precisión la totalidad de las pruebas.
He aquí algunos consejos para utilizar RWD/RWE en apoyo de su presentación reglamentaria:
- Complementar, no sustituir los ensayos clínicos: RWD/RWE mejora las pruebas de seguridad y eficacia, pero no sustituye a los ensayos clínicos bien diseñados.
- Limitaciones transparentes: Reconocer la naturaleza observacional de RWD/RWE, los posibles sesgos y los factores de confusión no controlados.
- Colabore con las agencias reguladoras: Trabaje en estrecha colaboración con las agencias reguladoras para alinear su uso de RWD/RWE con sus expectativas.
Siguiendo estos pasos y consejos, puede utilizar RWD/RWE para apoyar su presentación reglamentaria y llevar su producto al mercado de forma más rápida y eficaz.
Al embarcarse en este viaje RWD y RWE, recuerde que está allanando el camino para presentaciones regulatorias más eficientes e informadas. El futuro de la innovación farmacéutica reside en las pruebas del mundo real. Adóptela, aprovéchela y deje su huella en la industria.
¿Listo para optimizar su proceso de presentación de documentos reglamentarios? Descubra nuestro software de vanguardia para la presentación de documentos reglamentarios Freyr PRO hoy mismo.









