
Wyobraź sobie, że pracujesz nad nowym lekiem na wyniszczającą chorobę. Po latach ciężkiej pracy w końcu zebrałeś dane potrzebne do złożenia wniosku regulacyjnego do FDA. Ale wtedy zdajesz sobie sprawę, że Twoje elektroniczne rejestry i podpisy elektroniczne nie są zgodne z 21 CFR Part 11. Jest to scenariusz, w którym nikt nie chciałby się znaleźć. Świat zgodności z przepisami jest złożony i nieustannie się zmienia. W związku z ciągłym wprowadzaniem nowych przepisów przedsiębiorstwom może być trudno nadążyć za zmianami. Istnieje jednak jeden przepis, który ma zasadnicze znaczenie dla każdej firmy działającej w branży podlegającej regulacjom: 21 CFR Part 11.
21 CFR Part 11 rozporządzenie, które określa kryteria dotyczące dokumentacji elektronicznej i podpisów elektronicznych w branżach FDA. Ma ono na celu zapewnienie, że dokumentacja elektroniczna jest wiarygodna, rzetelna i równoważna z dokumentacją papierową i podpisami odręcznymi. 21 CFR Part 11 znaczenie dla wniosków regulacyjnych, ponieważ zawiera wytyczne dotyczące zapewnienia zgodności dokumentacji elektronicznej i podpisów elektronicznych z FDA . Jest to ważne, ponieważ wnioski regulacyjne często zawierają znaczną ilość danych elektronicznych, takich jak dane z badań klinicznych, dokumentacja produkcyjna i dane dotyczące kontroli jakości.
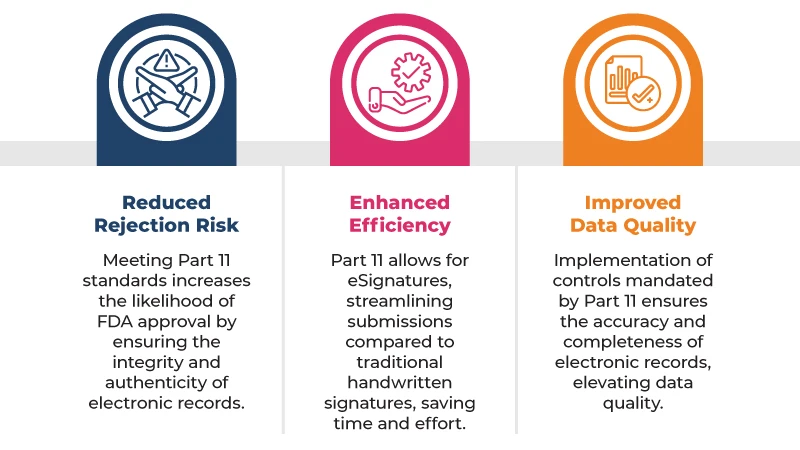
Oto kilka kluczowych korzyści wynikających ze zgodności z 21 CFR Part 11 wniosków regulacyjnych:
Aby zachować zgodność z 21 CFR Part 11, firmy muszą wdrożyć szereg środków kontroli, w tym:
- Weryfikacja systemów: Upewnij się, że systemy elektroniczne spełniają wymagania części 11, w tym solidne zabezpieczenia, ścieżki audytu i testy integralności danych.
- Kontrola dostępu użytkowników: Ograniczenie dostępu do autoryzowanego personelu poprzez ochronę hasłem, podpisy elektroniczne i inne metody uwierzytelniania.
- Utrzymywanie ścieżek audytu: Wdrożenie ścieżek audytu w celu śledzenia wszystkich zmian rekordów, umożliwiając wykrywanie i badanie nieautoryzowanych zmian.
- Zapewnienie bezpieczeństwa danych: Stosowanie środków bezpieczeństwa danych w celu ochrony dokumentacji elektronicznej przed nieuprawnionym dostępem, wykorzystaniem, ujawnieniem, zakłóceniem, modyfikacją lub zniszczeniem.
Przestrzegając przepisów 21 CFR Part 11, firmy mogą zapewnić wiarygodność i rzetelność swoich elektronicznych danych z badań klinicznych. Jest to ważne, ponieważ FDA chętniej zatwierdzają wnioski regulacyjne zawierające wysokiej jakości elektroniczne dane z badań klinicznych.
21 CFR Part 11 jest niezbędna do pomyślnego złożenia wniosku do FDA. Dzięki oprogramowaniu do składania wniosków, takim jak Freyr PRO, które centralizuje zarządzanie, usprawnia współpracę i zapewnia szybkie składanie wniosków eCTD oraz jest 21 CFR Part 11 , można to osiągnąć. Aby dowiedzieć się więcej, zamów prezentację już teraz!









