
Przyjęcie standardu eCTD 4.0 stanowi kluczowy krok w kierunku modernizacji procesów składania wniosków regulacyjnych na całym świecie. Biorąc pod uwagę korzyści, takie jak ulepszone śledzenie dokumentów i wydajność metadata, nie dziwi fakt, że agencje na całym świecie z zadowoleniem przyjmują tę zmianę.
Ale jakie jest EMA ? W przeciwieństwie do FDA, która nakreśliła jasne etapy wdrażania, EMA bardziej wyważone podejście, zaczynając od programów pilotażowych i ocen technicznych. W tym blogu przedstawiamy plany EMAdotyczące eCTD 4.0, ich potencjalny wpływ na zgłoszenia regulacyjne oraz sposoby, dzięki którym Twoja firma może utrzymać przewagę nad konkurencją.
Co ważniejsze, czy EMA już EMA eCTD 4.0? Przyjrzyjmy się temu bliżej.
Czym jest eCTD 4.0 i czym różni się od eCTD 3.2.2?
Elektroniczny Wspólny Dokument Techniczny (eCTD) to akceptowany na całym świecie format składania wniosków regulacyjnych. Standaryzuje on sposób, w jaki firmy farmaceutyczne składają wnioski o leki i zarządzają aktualizacjami cyklu życia na różnych rynkach.
Obecna wersja, eCTD 3.2.2, jest używana od lat. Jednak organy regulacyjne, w tym EMA, pracują nad wersją eCTD 4.0, która opiera się na standardzie Health Level 7 (HL7) Regulated Product Submission (RPS). Ta aktualizacja zwiększa wydajność składania wniosków i usprawnia zarządzanie cyklem życia regulacyjnego.
Kluczowe różnice między eCTD 3.2.2 i eCTD 4.0:
- Lepsze zarządzanie cyklem życia: Ulepszone śledzenie wersji dokumentów, ograniczające ich powielanie.
- Bardziej elastyczna szczegółowość: Umożliwia ponowne wykorzystanie ustrukturyzowanych dokumentów w różnych zgłoszeniach.
- Ulepszona Metadata : Bardziej ustrukturyzowane metadata, usprawniające interakcje regulacyjne.
- Większa interoperacyjność: Zaprojektowany, aby lepiej współpracować z ewoluującymi cyfrowymi systemami regulacyjnymi na całym świecie.
- Chociaż zmiany te oferują liczne korzyści, przejście na eCTD 4.0 wymaga przygotowania, inwestycji i zrozumienia oczekiwań regulacyjnych.
Stanowisko EMAw sprawie przyjęcia standardu eCTD 4.0
Wszyscy zadają sobie pytanie: czy EMA formatu eCTD 4.0? Odpowiedź brzmi: jeszcze nie, ale proces ten jest w toku.
Aktualny status eCTD 4.0 w UE:
- Obecnie eCTD 3.2.2 pozostaje obowiązkowym standardem dla zgłoszeń w UE.
- EMA aktywnie EMA format eCTD 4.0, ale nie wprowadziła jeszcze oficjalnego obowiązku jego stosowania.
- Agencja współpracuje z innymi organami regulacyjnymi, takimi jak FDA japońska PMDA, w celu ujednolicenia globalnych standardów.
- Nie ustalono żadnych oficjalnych terminów przejścia, ale EMA , że eCTD 4.0 ostatecznie stanie się obowiązkowe.
Podejście EMA: stopniowe wdrażanie wraz z programem pilotażowym
W przeciwieństwie do amerykańskiej agencji USFDA, która opracowała plan stopniowego wdrażania, EMA podejście strukturalne. Agencja uruchomiła program pilotażowy, aby przetestować wdrożenie eCTD 4.0 wraz z zainteresowanymi podmiotami z branży.
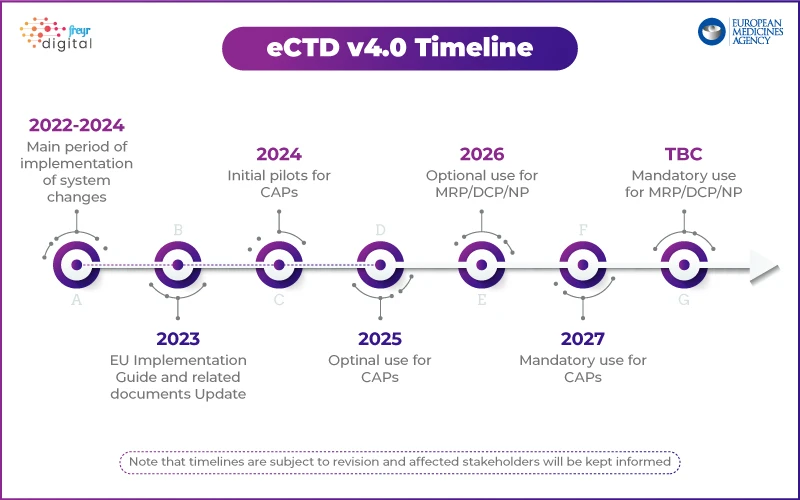
Najważniejsze punkty strategii EMAdotyczącej eCTD 4.0:
- Krok 1: Skupienie się na technicznej interoperacyjności z narzędziami regulacyjnymi.
- Przyszłe fazy: Próbne zgłoszenia, zarządzanie cyklem życia i zgłoszenia grupowe.
- Dostępny jest projekt pakietu wdrożeniowego ze słownikami kontrolowanymi i kryteriami walidacji.
EMA wszelkich starań, aby zapewnić płynne przejście, a firmy z branży nauk przyrodniczych powinny śledzić aktualizacje na oficjalnej stronie EMA .
Wyzwania i rozważania dla firm z branży nauk przyrodniczych
Chociaż eCTD 4.0 oferuje wyraźne korzyści, jego przyjęcie nie jest pozbawione wyzwań. Oto kilka kluczowych kwestii dla firm farmaceutycznych i biotechnologicznych:
- Złożoność przepisów
- Stopniowe przejście EMA oznacza, że firmy muszą być przygotowane na podwójne procesy składania wniosków (eCTD 3.2.2 i eCTD 4.0).
- Różne regiony będą miały różne harmonogramy wdrażania, co będzie wymagało od firm zachowania elastyczności.
- Wyzwania techniczne
- Migracja danych z eCTD 3.2.2 do 4.0 wymaga starannego planowania.
- Zasady walidacji znacznie się zmienią, wymagając zaktualizowanego oprogramowania i narzędzi.
- Firmy muszą inwestować w automatyzację i rozwiązania oparte na sztucznej inteligencji, aby zapewnić zgodność z przepisami.
- Ryzyko braku zgodności
- Nieprawidłowe metadata lub niezgodność z nowymi wymaganiami dotyczącymi szczegółowości dokumentów może skutkować odrzuceniem zgłoszenia.
- Zespoły regulacyjne potrzebują odpowiedniego szkolenia, aby zrozumieć nowe zasady walidacji.
- Wpływ na istniejące przepływy pracy
- Firmy będą musiały dostosować wewnętrzne procesy do eCTD 4.0.
- Konieczna będzie ściślejsza współpraca między zespołami ds. regulacji, IT i składania wniosków.
Najważniejsze wnioski? Firmy muszą zacząć przygotowania już teraz, mimo że EMA nie EMA jeszcze obowiązku stosowania eCTD 4.0.
Jak firmy mogą przygotować się do przejścia na format eCTD 4.0 wymagany przez EMA
Mimo że EMA wyznaczyła oficjalnego terminu, proaktywne firmy skorzystają na wcześniejszych przygotowaniach. Oto jak:
- Ocena bieżących procesów składania wniosków
- Identyfikacja luk w istniejących przepływach pracy eCTD 3.2.2.
- Oceń, w jaki sposób nowe zasady zarządzania cyklem życia wpłyną na bieżące zgłoszenia.
- Zainwestuj w odpowiednie narzędzia eCTD 4.0
- Wybierz oprogramowanie do składania wniosków zgodne ze standardem eCTD 4.0.
- Upewnij się, że oprogramowanie obsługuje standardy HL7 RPS i metadata .
- Szkolenie zespołów ds. regulacji i IT
- Przeprowadzenie warsztatów i sesji szkoleniowych dotyczących zmian w eCTD 4.0.
- Zapewnij wytyczne dotyczące metadata i śledzenia cyklu życia.
- Współpraca z EMA innymi podmiotami z branży
- Weź udział w programach pilotażowych EMAi konsultacjach regulacyjnych.
- Bądź na bieżąco z najnowszymi wytycznymi i aktualizacjami regulacyjnymi EMA.
- Przeprowadzanie testów i walidacji
- Uruchamianie wewnętrznych zgłoszeń testowych przy użyciu struktur eCTD 4.0.
- Zidentyfikuj potencjalne problemy związane z szczegółowością dokumentów i metadata przed ostatecznym mandatem EMA.
Rozpoczynając teraz, firmy mogą zapewnić płynne przejście bez zakłóceń w wypełnianiu dokumentów regulacyjnych.
Co dalej? Przyszłość eCTD 4.0 w Europie
Chociaż pełny harmonogram przejścia pozostaje niejasny, długoterminowa strategia EMA obejmuje:
- Standaryzacja zgłoszeń na rynkach globalnych, poprawa spójności i wydajności.
- Skrócenie czasu zatwierdzania dzięki lepszemu śledzeniu cyklu życia zgłoszeń.
- Integracja sztucznej inteligencji i automatyzacji z regulacyjnymi przepływami pracy w celu zwiększenia zgodności.
W ciągu najbliższych kilku lat możemy spodziewać się większej jasności ze strony EMA, w tym oficjalnych harmonogramów przejścia i nowych kryteriów walidacji.
Wnioski
Chociaż EMA nie EMA jeszcze obowiązku stosowania formatu eCTD 4.0, to tylko kwestia czasu, zanim stanie się on standardem dla wniosków regulacyjnych w UE. Firmy, które aktywnie się do tego przygotują, zyskają przewagę konkurencyjną, zapewniając zgodność z przepisami i unikając przeszkód regulacyjnych w ostatniej chwili.
Kluczowe wnioski
- eCTD 3.2.2 pozostaje aktualnym standardem, ale na horyzoncie pojawia się eCTD 4.0.
- EMA podejście stopniowe i nie EMA jeszcze oficjalnego mandatu.
- Firmy powinny rozpocząć przygotowania już teraz, aby zapewnić płynne przejście.
- Kluczowe będzie inwestowanie w nowe technologie, szkolenie zespołów i testowanie zgłoszeń.
Wezwanie do działania
Bądź na bieżąco z ogłoszeniami regulacyjnymi EMAi zacznij oceniać swoją gotowość do wdrożenia eCTD 4.0. Im szybciej się przygotujesz, tym łatwiejsze będzie przejście na nowy system, gdy wejdzie on w życie.
Czy potrzebujesz pomocy w wyborze oprogramowania zgodnego z eCTD 4.0 lub zrozumieniu, jak ta zmiana wpłynie na Twoją działalność? reach z us.









