
Świat przepisów farmaceutycznych wkrótce doczeka się poważnej aktualizacji wraz z wdrożeniem eCTD 4.0. Ten znormalizowany format obiecuje płynniejszą podróż dla nowych wniosków o leki składanych do organów regulacyjnych. Ale dla firm, które chcą zdobyć część japońskiego rynku farmaceutycznego o wartości 141,5 miliarda dolarów, istnieje kluczowy zwrot - Japonia przyspiesza czas przyjęcia!
Poniżej znajduje się analiza tych najważniejszych wydarzeń:
- Obowiązkowe przyjęcie: W przeciwieństwie do innych obszarów, które mają dobrowolne fazy przed obowiązkowym przyjęciem, do 2026 r. Japonia zamierza wprowadzić obowiązek korzystania z eCTD 4.0.
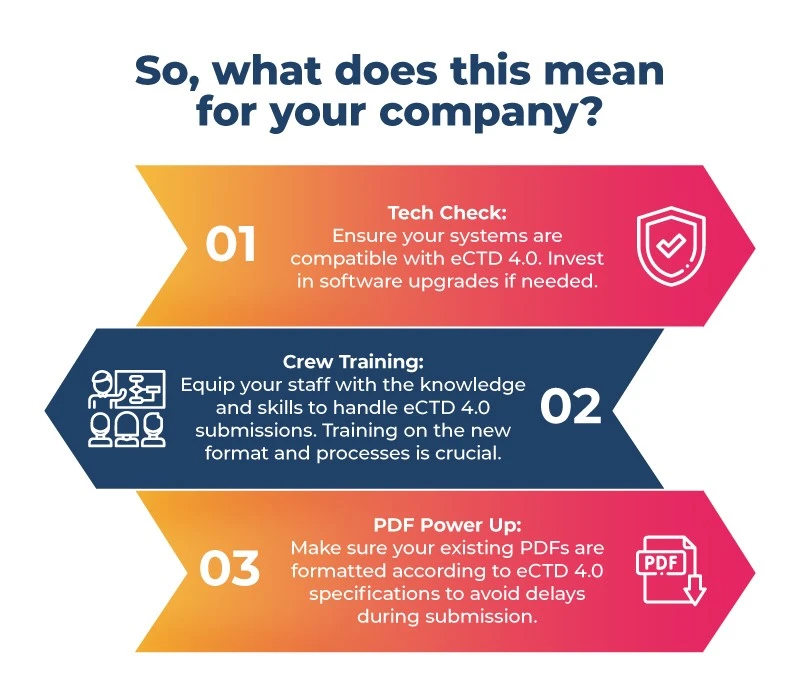
- Przygotowanie jest kluczowe: Przygotowanie jest kluczowe ze względu na ograniczenia czasowe i brak bezpośredniej ścieżki migracji z PMDA JP1.0 japońskiej PMDA do PMDA eCTD 4.0. Skupienie się na lepszym systemie pomoże firmom farmaceutycznym w Japonii w procesie przejścia. Kroki te obejmują aktualizację oprogramowania, szkolenie personelu i przygotowanie plików PDF do nowego formatu.
- Dostępne zasoby: Japońska wyroby medyczne ds. Produktów Leczniczych i wyroby medyczne (PMDA) opublikowała materiały, które mogą pomóc firmom w dostosowaniu się do tych zmian, takie jak „Przewodnik wdrożeniowy dotyczącyICH wspólnego dokumentu technicznegoICH eCTD 4.0” zawierający wyjaśnienia dotyczące wprowadzonych zmian i najlepszych praktyk.
Oto kilka powodów, dla których nie powinieneś przegapić tej gry liczbowej:
- Szybka droga do eCTD 4.0: W przeciwieństwie do innych regionów, gdzie proces ten przebiega etapowo, Japonia zamierza wprowadzić obowiązkowe stosowanie eCTD 4.0 już w 2026 r. Jest to trzy lata przed terminem wyznaczonym przez US FDA 2029 r.! Tak agresywny harmonogram oznacza, że Japonia objęła prowadzenie w zakresie globalnego wdrażania eCTD.
- Brak miejsca na błędy: JP nie może być bezpośrednio konwertowany do eCTD 4.0 w przeciwieństwie do poprzednich wersji. Oznacza to, że firmy farmaceutyczne muszą być na to bardzo przygotowane, aby zapobiec opóźnieniom w składaniu wniosków, które mogą kosztować je miliony przychodów.
- Pomoc w płynnym wejściu na rynek: Japońska wyroby medyczne ds. Produktów Farmaceutycznych i wyroby medyczne (PMDA) rozumie związane z tym wyzwania. Opracowała ona materiały, takie jak przewodniki wdrożeniowe, które mają pomóc firmom w łatwym przeprowadzeniu tych zmian i płynnym wejściu na rynek japoński. (pmda).
Jeśli opracowujesz leki na ogromny rynek japoński, czas się spiąć! Oto lista kontrolna przed lotem:
Przejście na eCTD 4.0 obiecuje zwiększoną wydajność i globalną standaryzację całego procesu zatwierdzania leków farmaceutycznych. Twoja firma może przewidzieć tę zmianę w Japonii, aby zapewnić płynne przejście i skorzystać z niezliczonych możliwości, jakie oferuje ta nowa era. Pamiętaj, że brak przygotowania oznacza przygotowanie się na porażkę, więc bądź gotowy, aby wzbić się w powietrze dzięki eCTD 4.0 w Japonii.
Korzyści i możliwości, jakie się z tym wiążą, są atrakcyjne dla branży farmaceutycznej. Jednak proces ten wiąże się również z pewnymi trudnościami, które należy rozwiązać. Aby płynnie poruszać się w nieustannie zmieniającym się środowisku regulacyjnym, firmy mogą nawiązać współpracę z wiarygodnymi konsultantami, takimi jak Freyr. Wkrocz w przyszłość składania wniosków regulacyjnych w Japonii dzięki naszemu niezrównanemu oprogramowaniu eCTD, Freyr SUBMIT PRO, które jest zgodne 21 CFR Part 11 i ma elastyczny model wdrażania. Skontaktuj się us , aby dowiedzieć się więcej i rozpocząć podróż ku większej wydajności i sukcesowi. Zamów prezentację już dziś.









