Koszty zapewnienia zgodności z przepisami ponoszone przez firmy farmaceutyczne mogą stanowić nawet 25% ich całkowitych kosztów operacyjnych. Firmy farmaceutyczne z wieloma portfelami produktów stoją przed wyjątkowymi wyzwaniami związanymi z zarządzaniem globalną zgodnością, śledzeniem dokumentacji i nadzorowaniem zmian w etykietach. Złożoność wymogów regulacyjnych w różnych regionach, w połączeniu z ręczną obsługą ogromnych ilości danych, może prowadzić do niezgodności, opóźnień w zatwierdzeniach rynkowych i nieefektywności operacyjnej.
Niniejszy blog poświęcony jest kluczowym wyzwaniom napotykanym przez firmy farmaceutyczne podczas zarządzania wieloma portfelami produktów i pokazuje, w jaki sposób oprogramowanie regulacyjne, poparte rzeczywistymi studiami przypadków, oferuje strategiczne rozwiązanie tych problemów.
Kluczowe wyzwania w zarządzaniu wieloma portfelami produktów
- Złożone globalne wymogi dotyczące zgodności: Każdy kraj ma własny organ regulacyjny, a jego wymogi mogą się znacznie różnić. Na przykład US FDA, EMA i japońska PMDA różne formaty składania wniosków, terminy i standardy zgodności. Firmy farmaceutyczne muszą zarządzać różnorodnymi dokumentami w wielu regionach, zapewniając jednocześnie zgodność z lokalnymi przepisami.
- Śledzenie zmian etykiet w różnych regionach: Zarządzanie zmianami etykiet dla różnych regionów i zapewnienie terminowych aktualizacji jest jednym z najtrudniejszych aspektów zarządzania portfolio. Niewłaściwe zarządzanie zmianami etykiet może prowadzić do niezgodności, wycofywania produktów i poważnych komplikacji finansowych.
- Przeciążenie dokumentacją: Składanie dokumentacji i zarządzanie nią w wielu liniach produktów, z których każda znajduje się na różnych etapach rozwoju, może szybko przytłoczyć wewnętrzne zespoły. Ręczna obsługa aktualizacji cyklu życia produktu często prowadzi do błędów i opóźnionych zatwierdzeń.
- Niewłaściwe zarządzanie zasobami: Zespoły często mają trudności z efektywnym przydzielaniem odpowiednich zasobów. Bez solidnego systemu zarządzania, firmy mogą przeciążać pracowników zadaniami administracyjnymi, ograniczając ich zdolność do skupienia się na kluczowych działaniach strategicznych.
- Silosy danych: Brak centralizacji oznacza, że dane związane ze zgłoszeniami, zatwierdzeniami i aktualizacjami produktów są przechowywane w różnych systemach, co prowadzi do nieefektywności, błędnej komunikacji i trudności w utrzymaniu całościowego obrazu cyklu życia produktu.
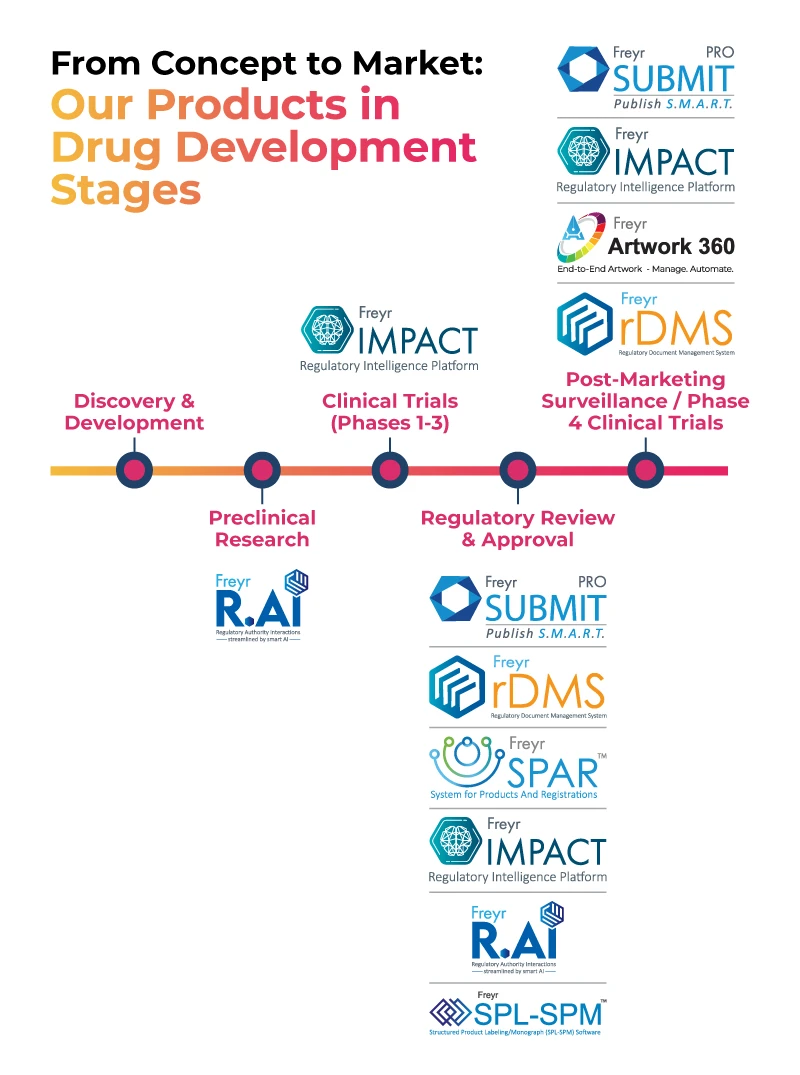
Pakiet produktów technologicznych Freyr wspiera firmy farmaceutyczne od momentu powstania koncepcji do wprowadzenia produktu na rynek, jak pokazano na poniższym obrazku.
Studia przypadków: Jak oprogramowanie regulacyjne zapewnia przewagę strategiczną
Wdrażając oprogramowanie regulacyjne, firmy farmaceutyczne mogą zautomatyzować procesy, zapewnić zgodność z przepisami i ostatecznie uzyskać strategiczną przewagę nad konkurencją. Poniższe studia przypadków przedstawiają rzeczywiste przykłady tego, jak nasze rozwiązania w zakresie oprogramowania regulacyjnego pomogły firmom farmaceutycznym sprostać tym wyzwaniom.
Sprawdzony przypadek
Wyzwanie dla klienta
US firma farmaceutyczna produkująca leki generyczne miała trudności z efektywnym zarządzaniem end-to-end i dokumentacją. Rozproszone repozytoria dokumentów utrudniały zapewnienie płynnego dostępu do dokumentów regulacyjnych zarówno dla wewnętrznych, jak i zewnętrznych interesariuszy. Ponadto proces tworzenia i zarządzania Structured Product Labeling (SPL) uciążliwy, co powodowało opóźnienia w terminach składania wniosków i wydłużanie cykli przeglądów.
Rozwiązanie Freyr
Firma Freyr Digital wkroczyła jako dostawca wirtualnego Sprawy regulacyjne , wdrażając trzy kluczowe produkty jako rozwiązania odpowiadające na wyzwania klienta:
- Freyr : Scentralizowany system zarządzania dokumentami, który stanowi jedyne źródło informacji o wszystkich zgłoszeniach regulacyjnych i dokumentach, zapewniając dostęp w czasie rzeczywistym i kontrolę wersji zarówno dla zespołów wewnętrznych, jak i partnerów zewnętrznych.
- Freyr PRO: Potężne narzędzie do publikowania i składania dokumentów eCTD, usprawniające proces składania wniosków, skracające czas przygotowania i zapewniające zgodność z ewoluującymi standardami regulacyjnymi.
- Freyr : Efektywne rozwiązanie do zarządzania wszystkimi działaniami związanymi z SPL, znacznie usprawniające procesy tworzenia, zarządzania i składania dokumentów.
Wyniki
Wdrażając te rozwiązania, Freyr pomogła klientowi osiągnąć:
- Skrócenie czasu przygotowania zgłoszenia o 30%
- 100% zgodności ze wszystkimi wymogami regulacyjnymi
- 40% poprawa wydajności przetwarzania dokumentów
- Skrócenie cykli przeglądu o 25%
Podsumowanie: Transformacja cyfrowa dla strategicznego sukcesu
Zarządzanie wieloma portfelami produktów na rynkach globalnych to nie lada wyczyn. Jednak dzięki odpowiedniemu oprogramowaniu regulacyjnemu firmy farmaceutyczne mogą usprawnić procesy, zapewnić zgodność z przepisami i uzyskać strategiczną przewagę w branży.
Zestaw narzędzi regulacyjnych Freyr , w tym Freyr PRO, Freyr i Freyr – konsekwentnie pomagają firmom farmaceutycznym skrócić czas składania wniosków, poprawić zgodność z przepisami i zoptymalizować zasoby. Dzięki automatyzacji procesów ręcznych, scentralizowanemu zarządzaniu danymi i oferowaniu informacji w czasie rzeczywistym, nasze rozwiązania umożliwiają firmom farmaceutycznym utrzymanie przewagi na konkurencyjnym rynku. Skontaktuj się us.









