
Chiński przemysł farmaceutyczny odnotował znaczny wzrost od czasu przystąpienia do Światowej Organizacji Handlu (WTO). W 2021 r. Chiny będą miały 12% udziału w globalnym rynku farmaceutycznym, co czyni je drugim co do wielkości udziałowcem. Według agencji informacyjnej Xinhua, chiński rynek farmaceutyczny wygenerował 708,75 mld juanów w 2021 r., podczas gdy chińskie krajowe firmy medyczne zgromadziły 502 mld USD zysku.
Jak zapewne Państwo wiedzą, chiński urząd ds. zdrowia, National Medical Products Administration (NMPA), zaczął przyjmować wnioski eCTD Pozwolenie na dopuszczenie do obrotu produktu leczniczego MA) oraz wnioski o przeprowadzenie badań klinicznych (CTA), otwierając tym samym drogę do nowych możliwości. Jednak wiąże się to z pewnymi wyzwaniami.
W tym blogu analizujemy świat elektronicznych zgłoszeń Wspólnych Dokumentów Technicznych (eCTD), ponieważ szybko stają się one metodą przesyłania dokumentów w branży farmaceutycznej.
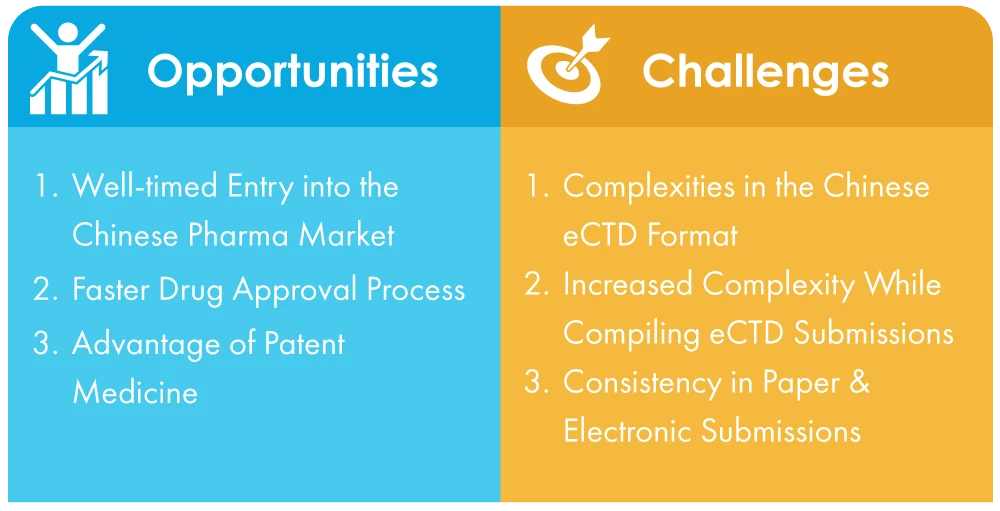
Wyzwania stojące przed firmami w Chinach związane z dostosowaniem się do obowiązkowych zgłoszeń eCTD
- Złożoność chińskiego formatu eCTD: W przeciwieństwie do uniwersalnego standardu, który jest dość prosty, chiński format eCTD jest skomplikowany i może być trudny do przejścia dla firm, które nie są zaznajomione z tym procesem. Może to prowadzić do niepowodzeń w przedstawianiu niezbędnych danych uwierzytelniających.
- Zwiększona złożoność podczas kompilowania zgłoszeń eCTD: NMPA, chiński organ ds. zdrowia, wdrożył nowe zasady i przepisy wspierające przejście na zgłoszenia elektroniczne, ale firmy nadal muszą poruszać się w złożonym i dynamicznym środowisku. Może to stanowić większe wyzwanie dla tych firm, które nie mają lokalnej obecności lub dogłębnego zrozumienia ekosystemu regulacyjnego Chin.
- Wielojęzyczna obsługa zgłoszeń papierowych i elektronicznych: Dokumenty muszą być składane w języku mandaryńskim z wersją angielską jako odniesieniem, co może być trudnym zadaniem dla firm, które nie mają powiązań z wykwalifikowanymi tłumaczami językowymi.
Możliwości związane z przejściem z wersji papierowej na bezdokumentową
- Wejście na chiński rynek farmaceutyczny w odpowiednim momencie: Wejście na chiński rynek stało się wygodniejsze dzięki wprowadzonym reformom i unowocześnieniom polityki. Jedną z kluczowych zmian jest przyjęcie elektronicznych zgłoszeń, co usprawnia proces i eliminuje wiele wyzwań, z którymi kiedyś borykały się firmy. Jest to świadectwo zaangażowania Chin w promowanie dostosowań strukturalnych, przekształceń proceduralnych i ogólnego wzrostu rynku.
- Szybszy proces zatwierdzania leków: Teraz, gdy zgłoszenia stały się elektroniczne, proces zatwierdzania leków będzie znacznie szybszy, a tym samym proces wprowadzania leków na rynek będzie płynniejszy i szybszy. Ostatecznie pomoże to dużym firmom farmaceutycznym zwiększyć udział Chin w globalnym rynku farmaceutycznym.
- Zalety opatentowanych leków: Leki patentowe są drugim co do wielkości segmentem produktów z dużymi marżami zysku. Jednak produkcja leków oryginalnych wiąże się z długimi okresami zwrotu, rosnącymi kosztami badań i rozwoju oraz wydłużonymi okresami badań i rozwoju. Dzięki wdrożeniu elektronicznych zgłoszeń wszystkie te przeszkody można pokonać. Od 2022 r. głównymi uczestnikami tego rynku są nadal firmy zagraniczne. W ten sposób jest to rynek niszowy, na który można kierować reklamy w tym segmencie.
Jak przygotować się na nowe wdrożenie w Chinach?
Przejście na obowiązkowe składanie wniosków w formacie eCTD w Chinach stwarza wiele możliwości dla firm, które chcą pozostać konkurencyjne na największym rynku farmaceutycznym świata. Dzięki współpracy z odpowiednim ekspertem firmy mogą z łatwością i pewnością poruszać się po stale zmieniającym się otoczeniu regulacyjnym. Aby wyprzedzić konkurencję, kluczowe znaczenie ma posiadanie lokalnej spółki zależnej, która rozumie przepisy HA. Freyr SUBMIT PRO, oprogramowanie do publikowania i składania wniosków, pomaga producentom w łatwym wejściu na chiński rynek farmaceutyczny. Aby dowiedzieć się więcej o tym narzędziu, poproś o prezentację.









