
Pomysł elektronicznego składania wniosków regulacyjnych dotyczących produktów farmaceutycznych powstał jeszcze przed pojawieniem się samego narzędzia eCTD. Pod koniec lat 80. US agencjaFDA Food and Drug Administration) oraz agencje europejskie rozważały wprowadzenie takich inicjatyw jak CANDA (Computer-Aided New Drug Application). Te wczesne działania miały na celu zwiększenie wydajności i ułatwienie dostępu do danych dla recenzentów.
Wprowadź standard eCTD (2003):
W 2003 r. Międzynarodowa Konferencja ds. Harmonizacji (ICH) wprowadziła przełomową zmianę: standard eCTD (elektroniczny wspólny dokument techniczny). Ten znormalizowany format został zaprojektowany w celu ustanowienia uniwersalnego języka dla elektronicznych zgłoszeń na całym świecie.
Pojawienie się narzędzi eCTD:
Wraz z przyjęciem standardu eCTD wzrosło zapotrzebowanie na specjalistyczne narzędzia eCTD. Narzędzia te przyniosły kilka kluczowych korzyści:
- Usprawnione tworzenie treści: Użytkownicy mogą bez wysiłku tworzyć i organizować dokumenty zgodnie ze strukturą eCTD.
- Solidna walidacja: narzędzia eCTD zapewniły zgodność zgłoszeń ze specyfikacjami technicznymi, zapobiegając opóźnieniom spowodowanym błędami formatowania.
- Efektywne zarządzanie cyklem życia: Zarządzanie wersjami, śledzenie wersji i utrzymywanie zgodności z przepisami staje się łatwiejsze.
Innowacje te zrewolucjonizowały proces składania wniosków regulacyjnych, czyniąc go bardziej wydajnym i niezawodnym.
W jaki sposób oprogramowanie Freyr automatyzuje tworzenie plików eCTD
Zaawansowane oprogramowanie Freyr , Freyr PRO, rozwiązuje te problemy poprzez automatyzację kluczowych aspektów tworzenia eCTD, zwiększając w ten sposób wydajność i ograniczając liczbę błędów ludzkich.
Optymalizacja zasobów: Automatyzując powtarzalne zadania, nasze oprogramowanie uwalnia cenne zasoby ludzkie. Specjaliści mogą skupić się na bardziej strategicznych i wartościowych działaniach, takich jak analiza danych, opracowywanie strategii regulacyjnych i angażowanie interesariuszy. Ta zmiana nie tylko zwiększa produktywność, ale także zmniejsza koszty operacyjne, zapewniając znaczny zwrot z inwestycji.
Zminimalizowane ryzyko błędu ludzkiego: Automatyzacja minimalizuje ryzyko błędu ludzkiego, zapewniając dokładne przesyłanie danych i prawidłowe formatowanie dokumentów. Wbudowane w oprogramowanie kontrole walidacyjne i mechanizmy wykrywania błędów dodatkowo poprawiają jakość i zgodność zgłoszeń z przepisami. Zmniejsza to potrzebę przeróbek i pomaga zapewnić terminowe zatwierdzanie.
Submissions Tracker do kompleksowej analizy zgłoszeń eCTD
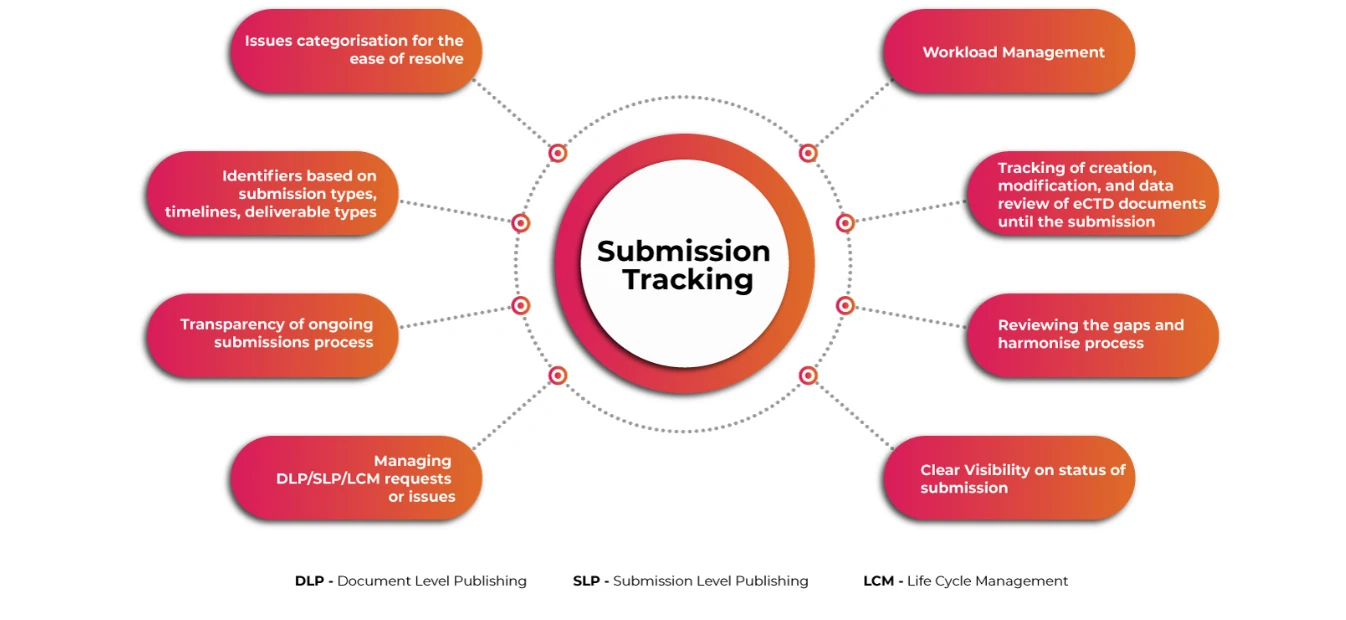
Przyjazny dla użytkownika zautomatyzowany system do planowania i śledzenia złożonych globalnych działań związanych ze składaniem wniosków eCTD, zarządzania przepływem pracy oraz przechowywania i zarządzania wnioskami regulacyjnymi i informacjami dotyczącymi składania wniosków jest koniecznością, aby zapewnić, że wnioskodawcy sprostają związanym z tym wyzwaniom na czas. Uzyskanie wglądu w operacje składania i publikowania na poziomie szczegółowym sprawia, że cały proces składania wniosków przebiega sprawniej i szybciej.
Śledzenie zgłoszeń
Najnowsza aktualizacja eCTD
Przejście na eCTD 4.0 oznacza większą wydajność i globalną standaryzację procesu zatwierdzania leków farmaceutycznych. Przygotowując się do tej zmiany, Twoja firma może płynnie przejść przez proces transformacji i wykorzystać liczne możliwości, era nowa era . Chociaż przejście na eCTD 4.0 może wiązać się z pewnymi wyzwaniami, można je pokonać dzięki zaangażowaniu i determinacji wszystkich zaangażowanych krajów. Chociaż konieczne będą znaczne inwestycje i wysiłki, istotne korzyści płynące z eCTD 4.0 sprawiają, że przedsięwzięcie to jest naprawdę warte zachodu.
Przegląd procesu przekazywania danych: eCTD 4.0 ma zrewolucjonizować sposób, w jaki firmy farmaceutyczne przekazują dane dotyczące opracowywania leków organom służby zdrowia. Ma on na celu usprawnienie procesu składania wniosków.
Harmonogram wdrożenia: FDA przyjmować nowe wnioski w formacie eCTD 4.0 od 2024 r. Kolejne etapy będą dotyczyły istniejących wniosków w wersji 3.2.2 oraz komunikacji dwukierunkowej.
Kompatybilność w przyszłości: eCTD 4.0 obejmuje kompatybilność w przyszłości, umożliwiając ponowne wykorzystanie treści v3.2.2 w cyklu życia i dokumentach. Upraszcza to konwersję aplikacji v3.2.2 do eCTD 4.0.
Kryteria walidacji: Dostępne są specyfikacje kryteriów walidacji eCTD 4.0. Kryteria te zapewniają jakość i dokładność zgłoszeń.
Globalna zgodność: Do 2026 r. organy regulacyjne na całym świecie mogą wymagać zgodności ze standardami eCTD 4.0. Chociaż obecnie jest to dobrowolne, egzekwowanie rozpocznie się między 2026 a 2029 rokiem.
Przyszłość eCTD:
Należy przyjąć sztuczną inteligencję z otwartymi ramionami i uczynić funkcję regulacyjną dynamiczną, ponieważ wnosi ona wartość dodaną do działalności firmy. Freya Fusion to najnowocześniejsza, oparta na sztucznej inteligencji, natywna dla chmury platforma do zarządzania informacjami regulacyjnymi (RIM), która zapewnia wyjątkową wydajność, bezpieczeństwo i skalowalność, przy jednoczesnym zachowaniu ścisłej zgodności z GxP. Wzbogacona o zaawansowane funkcjeML automatyzacji, Freya Fusion w świecie cyfrowym, zapewniając doskonałą funkcjonalność i wyjątkowe wrażenia użytkownika. Postępy w dziedzinie sztucznej inteligencji firmy Freyr zapewniają moduły tworzenia i śledzenia zgłoszeń, obejmujące funkcje płynnego kompilowania, publikowania i walidacji zgłoszeń regulacyjnych, gwarantujące skrupulatną zgodność z wytycznymi eCTD. Wyprzedzanie konkurencji w zakresie zgodności z przepisami dzięki opartemu na sztucznej inteligencji oprogramowaniu SaaS z pewnością przyniesie korzyści Twojej firmie. Niezależnie od tego, czy chodzi o system wczesnego ostrzegania o zmianach regulacyjnych, usprawniony przegląd i analizę dokumentów regulacyjnych, czy też analitykę predykcyjną do zarządzania ryzykiem, Freyr zapewni Ci wszystko, czego potrzebujesz. Reach z nami pod adresemhello@freyrdigital.com, aby poznać nasze innowacjeML, które usprawniają operacje regulacyjne w branży medycznej.
Wyprzedź konkurencję dzięki regularnym aktualizacjom i postępom technologicznym. Nawiąż z us współpracę, us usprawnić działania regulacyjne, zwiększyć produktywność i poprawić jakość składanych wniosków. Zamów prezentację już dziś i przekonaj się, jak doskonale łączą się w niej wiedza specjalistyczna i narzędzia. Przenieś swoją organizację z poziomu dobrego na doskonały. Skontaktuj się us już dziś.









