
W dynamicznym świecie farmaceutyków coraz większą rolę odgrywają dane rzeczywiste (RWD) i dowody rzeczywiste (RWE). Narzędzia te stanowią pomost między kontrolowanym środowiskiem badań klinicznych a złożonością rzeczywistej opieki nad pacjentami. Kilka firm farmaceutycznych z powodzeniem wykorzystało RWD/RWE do wsparcia swoich wniosków regulacyjnych. Na przykład w 2022 r. firma Bristol Myers Squibb otrzymała FDA na stosowanie leku Opdivo (niwolumab) w połączeniu z lekiem Yervoy (ipilimumab) w leczeniu pierwszego rzutu przerzutowego czerniaka na podstawie danych RWE z badania CheckMate 151.
Wraz z opublikowaniem w październiku 2023 r. FDA wytycznych FDA , które torują drogę do zmian, nadszedł czas, aby innowatorzy farmaceutyczni wykorzystali potencjał danych RWD i RWE do celów regulacyjnych.
RWD/RWE może być wykorzystywany do obsługi różnych zgłoszeń regulacyjnych, w tym:
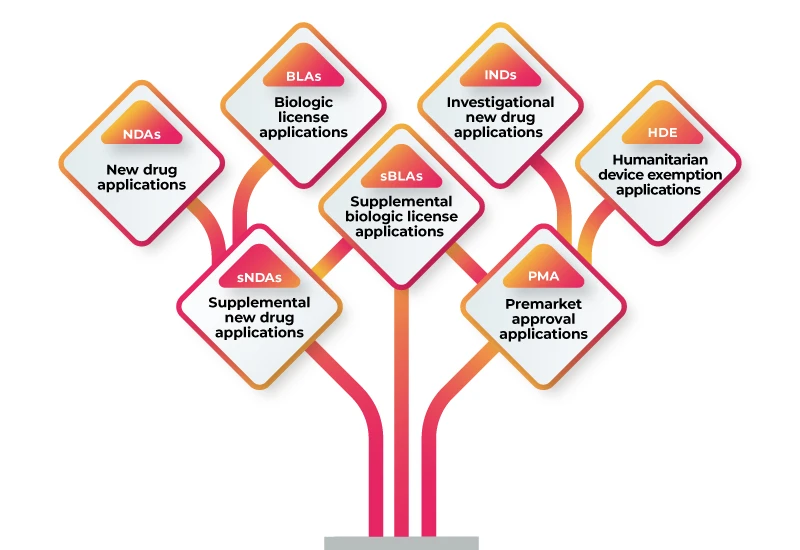
Aby użyć RWD/RWE do wsparcia zgłoszenia do organów regulacyjnych, należy wykonać następujące kroki:
Krok 1: Zdefiniuj pytanie regulacyjne
Rozpocznij swoją podróż od zidentyfikowania podstawowej kwestii regulacyjnej, na którą chcesz odpowiedzieć. Niezależnie od tego, czy chodzi o bezpieczeństwo, skuteczność czy wydajność w rzeczywistych scenariuszach, najważniejsza jest jasność celu.
Krok 2: Wybór wysokiej jakości źródeł RWD
Jakość jest tutaj kluczowa. Wybierz źródła RWD, które bezpośrednio korelują z Twoim pytaniem regulacyjnym. Elektroniczna dokumentacja medyczna, dane dotyczące roszczeń medycznych i rejestry pacjentów są nieocenionymi zasobami.
Krok 3: Opracowanie solidnego projektu badania
Projekt badania powinien odzwierciedlać pytanie regulacyjne i być zgodny z wytycznymi regulacyjnymi. Podejście musi być zgodne z oczekiwaniami FDA.
Krok 4: Analiza i generowanie RWE
Do analizy należy stosować solidne metody statystyczne. Jasna dokumentacja jest niezbędna do zapewnienia przejrzystości i wiarygodności.
Krok 5: Interpretacja i prezentacja wyników
Obiektywizm jest podstawą interpretacji RWE. Twoja prezentacja powinna być dostosowana do odbiorców, precyzyjnie przekazując całość dowodów.
Oto kilka wskazówek dotyczących korzystania z RWD/RWE w celu wsparcia składania wniosków regulacyjnych:
- Uzupełniają, nie zastępują badań klinicznych: RWD/RWE zwiększa dowody bezpieczeństwa i skuteczności, ale nie zastępuje dobrze zaprojektowanych badań klinicznych.
- Przejrzyste ograniczenia: Uznanie obserwacyjnego charakteru RWD/RWE, potencjalnych uprzedzeń i niekontrolowanych czynników zakłócających.
- Współpraca z organami regulacyjnymi: Ściśle współpracuj z agencjami regulacyjnymi, aby dostosować wykorzystanie RWD/RWE do ich oczekiwań.
Postępując zgodnie z poniższymi krokami i wskazówkami, można wykorzystać RWD/RWE do wsparcia procesu składania wniosków regulacyjnych oraz szybszego i skuteczniejszego wprowadzenia produktu na rynek.
Wyruszając w tę podróż RWD i RWE, pamiętaj, że torujesz drogę do bardziej wydajnych i świadomych zgłoszeń regulacyjnych. Przyszłość innowacji farmaceutycznych leży w rzeczywistych dowodach. Wykorzystaj je i odciśnij swoje piętno w branży.
Chcesz usprawnić proces składania wniosków regulacyjnych? Zapoznaj się z naszym najnowocześniejszym oprogramowaniem do składania wniosków regulacyjnych Freyr PRO już dziś!









