
Les affaires réglementaires (RA) jouent un rôle central dans la garantie de la sécurité, de l'efficacité et de la qualité des médicaments dans le paysage pharmaceutique en constante évolution. RA en matière de chimie, de fabrication et de contrôle (CMC) RA essentielles pour assurer la conformité. Elles visent à protéger la santé des patients et à promouvoir la confiance du public dans les produits pharmaceutiques en garantissant la cohérence et la qualité tout au long du processus de fabrication des médicaments.
RA CMC RA les exigences en matière de documentation et de conformité liées à la fabrication, au contrôle qualité et à la stabilité des produits pharmaceutiques. Elle implique une attention particulière aux détails et le respect des directives réglementaires tout au long du cycle de développement d'un médicament. Pour en savoir plus sur l'importance deRA CMC RA,consultez nos experts.
Dans cet article, nous allons nous pencher sur les principes fondamentaux de CMC RA explorer son importance dans la mise en conformité et le maintien de normes de qualité élevées.
Le rôle du CMC le développement des médicaments
CMC commencent dès le début du processus de développement d'un médicament et se poursuivent à toutes les étapes, de la recherche préclinique à la commercialisation. CMC et la documentation CMC sont des éléments essentiels des demandes réglementaires, telles que les demandes d'autorisation de nouveau médicament expérimental (IND), les demandes d'autorisation de nouveau médicament (NDA) et les demandes d'autorisation de mise sur le marché (MAA). Les autorités réglementaires examinent CMC afin d'évaluer la sécurité, l'identité, la puissance et la qualité d'un produit pharmaceutique, ainsi que la fiabilité et la cohérence du processus de fabrication.
Garantir la conformité avec CMC RA
Le respect des exigences CMC est essentiel pour réussir son entrée sur le marché. Les autorités réglementaires telles que la Food and Drug Administration (USFDA) des États-Unis, l'Agence européenne des médicaments (EMA) et d'autres autorités sanitaires régionales (AS) sont chargées d'établir les lignes directrices et les normes à respecter. Ces lignes directrices couvrent divers aspects, notamment les pratiques de fabrication, les systèmes qualité, les méthodes d'analyse, les tests de stabilité et la validation. La conformité implique une documentation méticuleuse, le respect des bonnes pratiques de fabrication (BPF) et la mise en œuvre de systèmes de gestion de la qualité (SGQ) efficaces.
Le rôle de CMC dans la réussite d'une entreprise pharmaceutique
Le maintien de normes élevées en matière de CMC offre plusieurs avantages aux entreprises pharmaceutiques. Voici quelques-uns des principaux avantages :
- Atténuer les risques réglementaires.
- Contribuer à l'obtention des autorisations réglementaires.
- Réduire la probabilité de rappels de produits.
- Favoriser une réputation positive de qualité et de fiabilité.
Points à prendre en considération pour assurerCMC bonCMC RA :
- Se tenir au courant des connaissances réglementaires: L'évolution des exigences réglementaires des autorités sanitaires exige de se tenir au courant des dernières directives. Il est essentiel de suivre en permanence les mises à jour réglementaires et de les intégrer dans CMC afin de maintenir la conformité.
- Mise en place de systèmes qualité: Cela comprend l'élaboration et la mise à jour Standard Operating Procedures (SOPs) complètes, de procédures de contrôle des documents, de processus de contrôle des changements et de programmes de formation afin de garantir que les employés comprennent et respectent les protocoles établis.
- Évaluation et atténuation des risques: Les entreprises doivent identifier les risques potentiels tout au long des processus de développement et de fabrication des médicaments et mettre en œuvre des stratégies appropriées d'atténuation des risques. Il s'agit notamment d'évaluer les paramètres critiques des processus, la variabilité des matières premières, les impuretés potentielles et les risques liés à la chaîne d'approvisionnement, afin de garantir la conformité.
- Documentation et intégrité des données: Le maintien d'une documentation précise et complète est essentiel pour démontrer la conformité. Les entreprises doivent mettre en place des pratiques de documentation solides, notamment en conservant les dossiers de lot, les données analytiques, les études de stabilité et les rapports de validation. Garantir l'intégrité, la traçabilité et la sécurité des données est essentiel pour éviter les problèmes de conformité.
- Gestion efficace du changement: Les entreprises doivent mettre en place des procédures de contrôle des changements bien définies afin d'évaluer et de documenter les changements, d'évaluer leur impact sur la qualité des produits et la conformité réglementaire, et d'obtenir les approbations nécessaires avant de mettre en œuvre les changements.
- Partenariats solides avec les fournisseurs et gestion :cela implique de sélectionner des fournisseurs qualifiés, de réaliser des audits et d'établir des accords de qualité qui définissent les responsabilités et les attentes. Il est essentiel de procéder à des évaluations régulières de la conformité des fournisseurs aux exigences actuelles en matière de bonnes pratiques de fabrication (cGMP).
- Préparation aux audits et aux inspections : Les entreprises doivent procéder à des auto-évaluations afin d'identifier les domaines d'amélioration et de se préparer aux audits réglementaires. En fait, il est essentiel de répondre rapidement aux conclusions des audits et de mettre en œuvre des actions correctives pour maintenir la conformité.
- Amélioration continue : Cet objectif peut être atteint en encourageant l'engagement des employés, en fournissant une formation et un enseignement sur les exigences réglementaires et en favorisant un état d'esprit axé sur la qualité à tous les niveaux de l'organisation.
- Les actions correctives et préventives (CAPA) : En traitant systématiquement les cas de non-conformité à l'aide de la méthodologie CAPA, les entreprises pharmaceutiques peuvent démontrer leur engagement en faveur de l'amélioration continue et de la conformité.
- Connaissance des modifications réglementaires post-approbation : Il est essentiel de comprendre les exigences réglementaires relatives aux modifications post-approbation pour garantir la conformité. La mise en œuvre de processus appropriés de gestion du changement et une communication efficace avec les AP peuvent aider à gérer ces changements tout en garantissant la conformité.
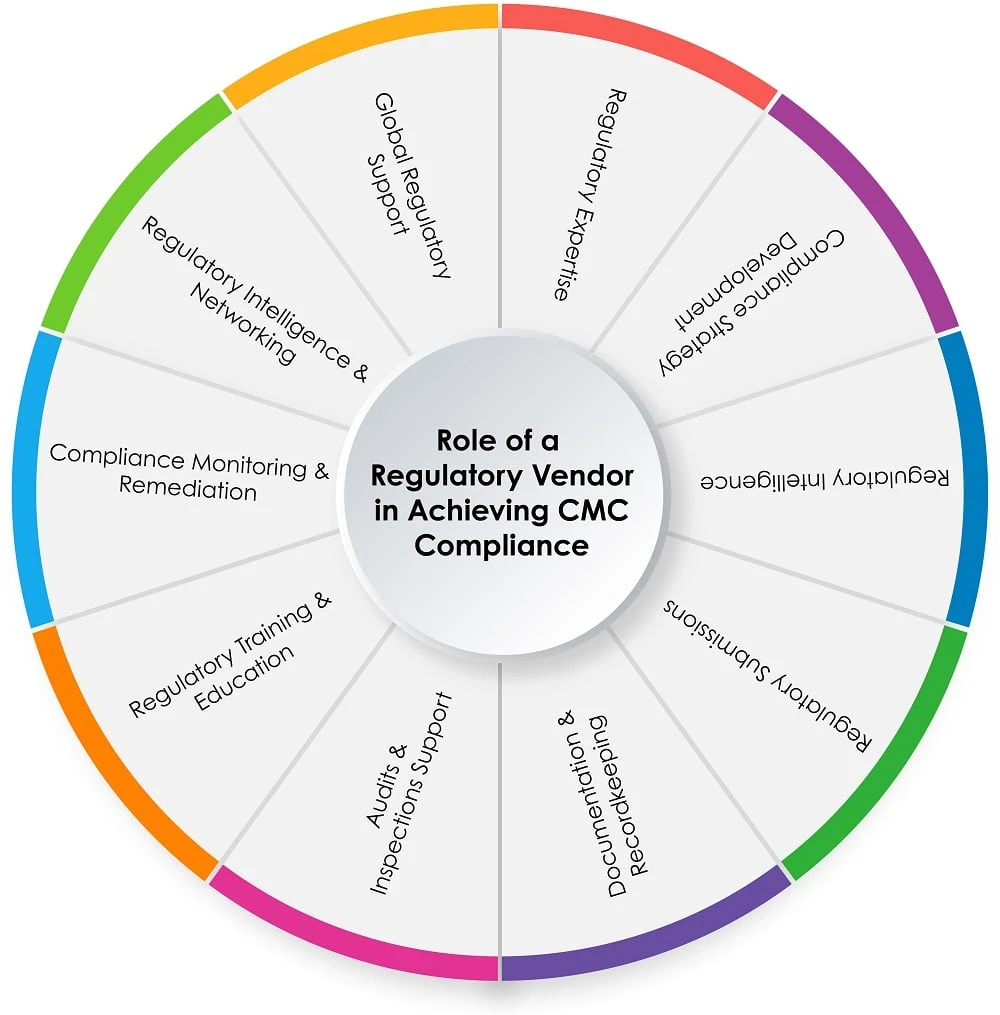
Rôle d'un fournisseur de services réglementaires dans le processus CMC
Le graphique circulaire ci-dessous (figure 1) illustre le rôle d'un fournisseur de services réglementaires dans le processus CMC :
Figure 1 : Rôle d'un fournisseur de services réglementaires dans la mise CMC
Conclusion
Pour atteindre et maintenir la conformité aux CMC , il faut adopter une approche stratégique qui implique une collaboration interfonctionnelle, des systèmes qualité solides et une veille réglementaire (RI) continue. Cela est également essentiel pour réussir l'accès au marché et garantir la disponibilité continue des produits. Une compréhension approfondie des principes fondamentaux deRA CMC RA la mise en œuvre de stratégies de conformité efficaces peuvent aider les entreprises pharmaceutiques à naviguer dans le paysage réglementaire, à obtenir des autorisations et à maintenir les normes les plus élevées en matière de qualité et de sécurité des patients.Des partenariats réglementairesstratégiques peuvent créer une synergie entre ces étapes cruciales en offrant une expertise de premier ordre pour rester en conformité. uspour en savoir plus sur nos services !









