
Le 9 février 2022, l'Agence européenne des médicaments (EMA) a commencé à mettre en place un centre de coordination pour l'analyse des données et l'intégration du réseau réel (DARWIN EU®). Il s'agit de la première étape vers l'intégration des données réelles (RWE) dans l'évaluation des médicaments dans l'Union européenne (UE). Garantir la sécurité et l'efficacité des médicaments est la principale activité de toute agence de réglementation, et les données du monde réel s'avèrent être une source fiable pour recueillir des preuves en temps réel à partir des bases de données mondiales sur les soins de santé. Cette initiative de EMA donc à améliorer la qualité des médicaments dans la région de l'UE et EMA les rendre disponibles plus rapidement.
Principales activités prévues pour le centre de coordination DARWIN EU®
Comment DARWIN EU® va-t-il aider EMA les autorités compétentes dans le domaine réglementaire ?
Les médicaments innovants facilement accessibles aux patients sont une nécessité absolue. Les processus réglementaires liés au développement, à l'autorisation, à la commercialisation et à la surveillance post-commercialisation prennent beaucoup de temps, ce qui empêche de répondre à la demande en médicaments novateurs. Il est donc nécessaire de réduire les délais de mise sur le marché tout en garantissant la sécurité, l'efficacité et la qualité des médicaments innovants. Plusieurs autorités sanitaires mondiales reconnaissent les avantages de l'intégration des données réelles (RWE) dans leurs autorisations réglementaires, et DARWIN EU® est l'initiative EMA.
EMA de connecter le réseau européen de réglementation des médicaments à l'espace européen des données de santé (EHDS) afin d'améliorer l'échange de données et l'accès à divers types de données de santé dans le cadre de ce programme. Elle établira également des normes pour les évaluations scientifiques et la prise de décision réglementaire.
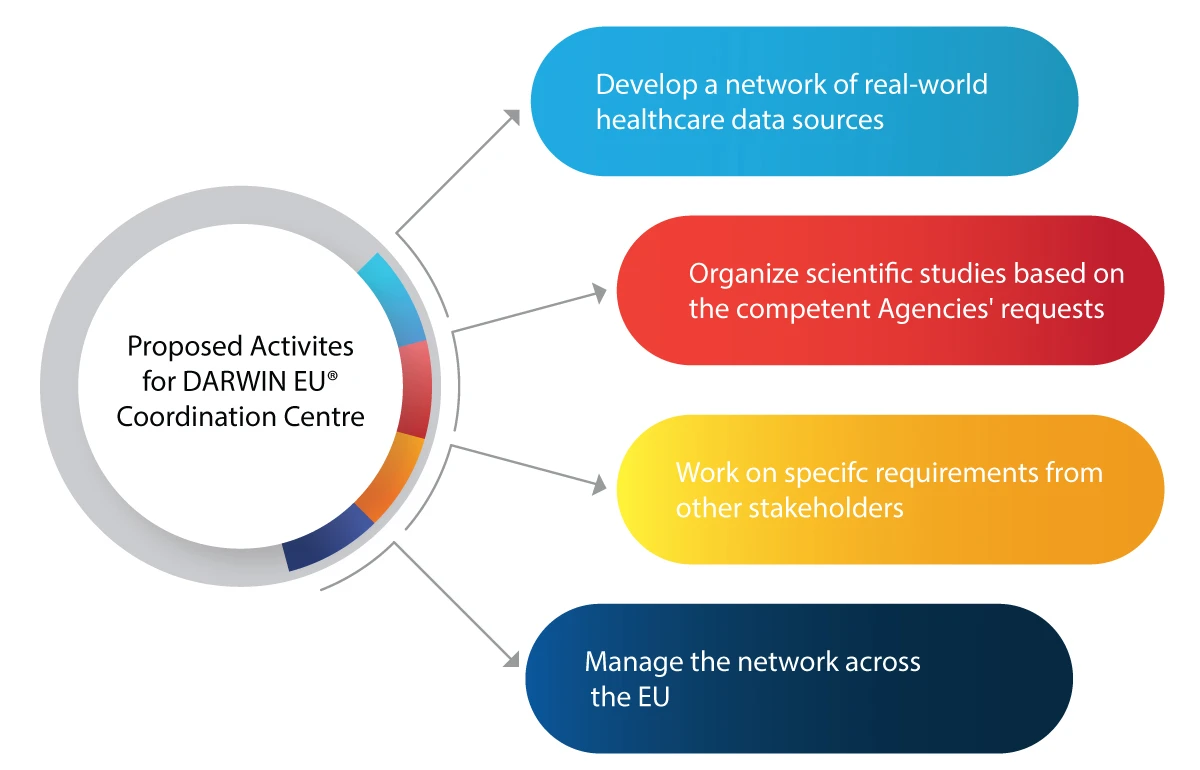
Voici quelques-unes des activités que le DARWIN EU® souhaite réaliser :
- Utilisation de l'ENR dans les activités de prise de décision pour la réglementation des nouveaux médicaments, vaccins, etc.
- Intégrer les données réelles dans l'ensemble du cycle de vie d'un médicament, notamment son développement, son autorisation et sa surveillance post-commercialisation.
- Se préparer à toute urgence médicale future, telle qu'une pandémie
- Faire bénéficier l'industrie pharmaceutique d'informations fiables et pertinentes sur les patients, les maladies et l'utilisation des médicaments.
- Prendre des décisions réglementaires éclairées sur la base de l'EEO pour une utilisation sûre et efficace des médicaments
- Amélioration de l'accès aux médicaments vitaux pour les patients qui en ont besoin grâce à une analyse précise et opportune des données
Calendrier proposé pour que DARWIN EU® devienne un réseau pleinement opérationnel dans l'UE
EMA précise EMA les délais pour que DARWIN EU® soit pleinement opérationnel, qui sont les suivants :
- 2021 - Lancement du projet
- 2022 – Création de DARWIN EU®
- 2023 – Développement de DARWIN EU® et définition de ses utilisations
- 2024 – Rendre DARWIN EU® pleinement opérationnel
- 2025 - Améliorer les utilisations réglementaires des données sur les soins de santé en élargissant les champs d'application en termes de médicaments, de géographie, etc.
EMA avec le Centre médical universitaire Erasmus de Rotterdam pour la mise en place de DARWIN EU®. L'objectif de ce partenariat est la création d'un centre de coordination chargé de mettre en place un réseau de données distribué. Les deux entités se sont également donné pour mission de mener des études scientifiques, de soutenir les processus décisionnels réglementaires et de gérer un catalogue de sources de données réelles.
Que signifie le lancement de DARWIN EU® pour l'avenir ?
EMA le groupe des responsables des agences de médicaments (HMA) ont toujours collaboré pour identifier les défis, fixer des objectifs assortis de délais et définir les priorités dans leurs documents stratégiques quinquennaux. L'objectif est de fournir une orientation stratégique aux activités menées par le réseau européen de réglementation des médicaments.
Le lancement de DARWIN EU® constitue une étape importante dans la mise en œuvre de la stratégie réseau EMA. Ses principaux objectifs sont de mener des études scientifiques pour répondre à des questions de recherche, de soutenir l'évaluation des médicaments dans l'UE et de gérer metadata médicaments. DARWIN EU® devrait jouer un rôle majeur dans la réglementation des médicaments en Europe, et les études pilotes devraient être prêtes d'ici la fin 2022.
Si vous êtes un fabricant de médicaments et souhaitez en savoir plus sur les données réelles (RWE) et leur influence sur l'avenir des décisions réglementaires, contactez les experts en affaires réglementaires de Freyr.









