
L'administration des produits thérapeutiques (TGA) en Australie applique des règles strictes pour l'enregistrement de nouveaux médicaments de prescription contenant de nouveaux principes actifs. Récemment, la TGA a proposé une procédure révisée afin d'améliorer l'efficacité des médicaments de prescription qui sauvent des vies et de les mettre plus rapidement à la disposition des patients. Ces changements concernent les demandes qui doivent être étayées par des données non cliniques, cliniques et/ou de bioéquivalence (catégorie 1 et catégorie 2). La TGA a publié en août un document détaillant les exigences réglementaires en la matière.
Principales caractéristiques de la nouvelle procédure d'enregistrement des médicaments délivrés sur ordonnance
- La TGA a mis au point un processus d'enregistrement par étapes, qu'elle a baptisé "milestones". Chacune d'entre elles suit une voie distincte.
- Le nouveau processus vise à améliorer la qualité des dossiers. Les dossiers sont préparés sur la base d'un format de document technique commun (CTD) et respectent toutes les exigences réglementaires.
- La phase de planification préalable à la soumission est importante car les demandeurs déposent les détails de leur future demande. Elle a lieu au moins deux mois et quart (02 ¼) avant la soumission du dossier complet. Cette étape a pour but d'aider la TGA à fixer les dates des étapes suivantes et à préparer les ressources nécessaires à la gestion du CTD.
- La phase suivante est la soumission. Une fois cette étape franchie, la TGA n'autorise pas le demandeur à fournir des données ou des informations supplémentaires après la date de soumission. Il est obligatoire de soumettre un dossier complet, correct et de haute qualité.
- En vertu de la section 31 du Therapeutic Goods Act 1989, la TGA demande des informations supplémentaires au stade de l'évaluation. Après l'évaluation initiale, toutes les demandes sont rassemblées et envoyées au demandeur.
Pour comprendre les étapes du processus de renouvellement, veuillez vous référer aux organigrammes suivants.
Première étape
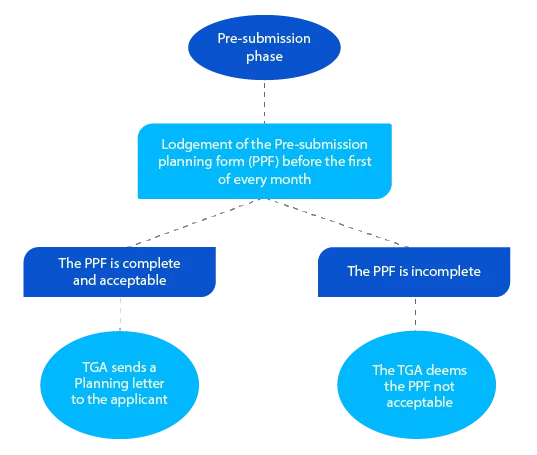
La lettre de planification contient la date à laquelle la TGA s'attend à ce que le dossier soit déposé et d'autres dates cibles pour la demande de médicament sur ordonnance.
Étape 2
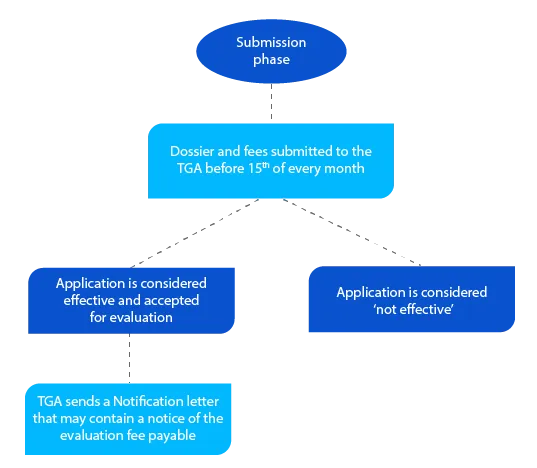
Le dossier contient des informations qui aident la TGA à évaluer la demande et, si tout est acceptable, une lettre de notification est envoyée avant la fin du mois au cours duquel le demandeur a soumis le dossier.
Étape 3
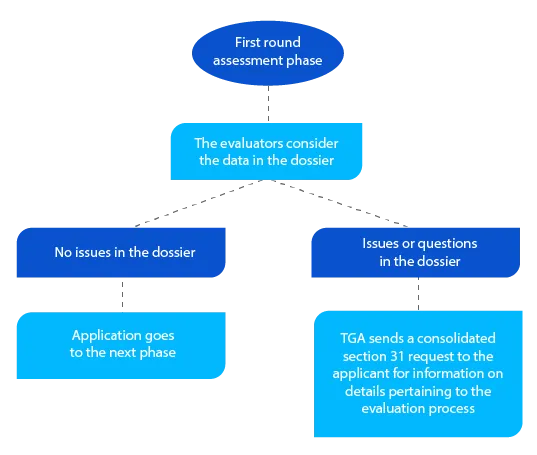
En plus de la demande consolidée au titre de l'article 31, la TGA envoie, le cas échéant, des copies des rapports d'évaluation préparés par les évaluateurs de la qualité, les évaluateurs non cliniques, les évaluateurs cliniques et les évaluateurs des plans de gestion des risques (Risk Management Plans - RMP).
Étape 4

Le demandeur peut désigner le délai de réponse au titre de l'article 31. Ce délai peut être de trente (30) ou soixante (60) jours et doit être indiqué dans le PPF. Ce délai doit être confirmé par la TGA dans la lettre de planification. Le format de réponse acceptable est le CTD, et la réponse doit être envoyée sous forme de copies papier et électronique.
Comme il s'agit de la dernière chance pour le demandeur de fournir les informations manquantes à la TGA, il doit le faire de manière conforme.
Cinquième étape
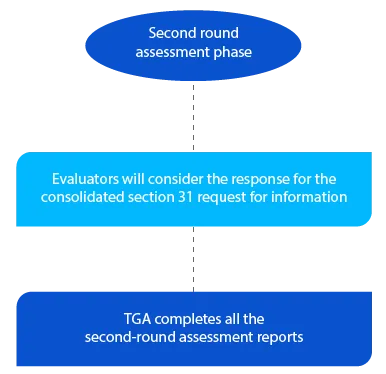
La TGA dispose de deux (02) mois pour les nouvelles demandes de médicaments génériques pour la deuxième série de rapports d'évaluation et d'un (01) mois pour tous les autres types de demandes. Les rapports sont envoyés aux demandeurs respectifs après l'achèvement de la deuxième évaluation.
Étape 6
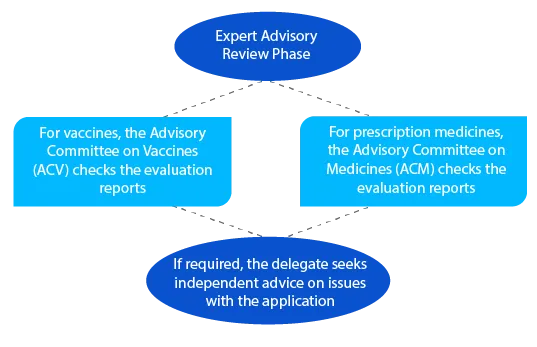
Après l'examen consultatif, la TGA envoie une notification contenant les détails de l'avis qu'elle a reçu de l'ACV ou de l'ACM.
Étape 7
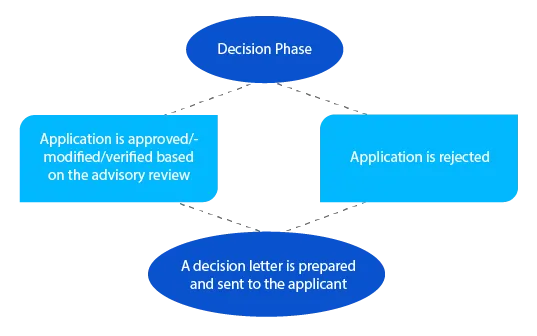
En cas de questions en suspens, le délégué peut prendre contact avec le demandeur au cours de cette phase avant de prendre une décision. Pour les demandes relevant de la section 23 du Therapeutic Goods Act de 1989 (médicaments nouvellement évalués et inscrits au registre australien des produits thérapeutiques (ARTG)), une notification est envoyée au demandeur dans les vingt-huit (28) jours suivant la prise de décision.
Jalon 8
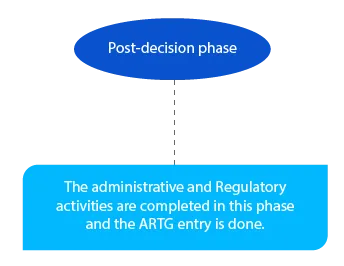
Les paiements en suspens sont pris en charge à ce stade. Elle doit être achevée à la fin du mois suivant la décision du délégué.
La TGA prenant toutes les précautions nécessaires pour garantir la sécurité, l'efficacité et la qualité des médicaments sur ordonnance tout en réduisant leur délai de mise sur le marché, il incombe au demandeur de fournir les informations pertinentes pour faciliter le processus d'enregistrement. À n'importe quelle étape, l'idéal est de collaborer avec un prestataire de services end-to-end , expert en enregistrement de médicaments sur ordonnance. Contactez un organisme réglementaire expérimenté pour obtenir une procédure conforme, rester informé et rester en conformité.









