
Les besoins médicaux non satisfaits (UMN) constituent l'une des priorités les plus urgentes des systèmes de santé. L'évolution constante de la science et de la technologie dans le domaine des soins de santé offre la possibilité d'explorer diverses options thérapeutiques. Les autorités sanitaires encouragent les thérapies innovantes qui promettent des avantages significatifs pour la qualité de vie des patients. S'appuyant sur la priorité accordée à l'innovation et ciblant les besoins non satisfaits des patients en matière de développement de médicaments, l'Agence européenne des médicaments (EMA) a introduit en 2016 la procédure PRIority MEdicines (PRIME). Depuis lors, la procédure PRIME est un moyen d'accorder des autorisations pour des thérapies innovantes dans des délais accélérés. Ce type de procédure facilitée peut être exploré par toute entreprise, qu'il s'agisse de start-ups, de sociétés biotechnologiques de taille moyenne ou de grandes multinationales. Toutefois, l'éligibilité à cette procédure est limitée aux produits en cours de développement et qui n'ont pas encore fait l'objet d'une demande d'autorisation de mise sur le marché dans le cadre de la procédure centralisée. Les critères d'éligibilité sont appliqués de manière rigoureuse. Entre mars 2016 et avril 2022, seules 24 % des demandes ont été approuvées, tandis que 72 % des demandes PRIME ont été rejetées. Parmi les 24 % qui ont été sélectionnés pour la procédure PRIME, la majorité appartenait au domaine thérapeutique de l'oncologie.
Les innovateurs qui cherchent à obtenir des autorisations de mise sur le marché pour des médicaments destinés au traitement de maladies rares ou orphelines disposent souvent de données limitées pour étayer leurs demandes d'autorisation de mise sur le marché, comme l'exigent les autorités réglementaires. Les demandes Produits médicaux pour Produits médicaux ATMP) et les médicaments orphelins sont généralement confrontées à ce type de difficultés. En raison du nombre limité de données sur la population de patients, une interaction constante avec les autorités réglementaires est encouragée afin de permettre une meilleure compréhension des exigences en matière d'examen scientifique et d'autorisation. La procédure PRIME peut être utile pour ce type de thérapies, car elle permet aux autorités réglementaires de s'impliquer dès le début en fournissant un soutien et des conseils proactifs pour la collecte de données et l'évaluation des risques et des bénéfices.
Les avantages de suivre la voie PRIME
- Aide les innovateurs à élaborer un plan de développement bien conçu.
- Les innovateurs bénéficient de l'engagement des autorités sanitaires dès les premières phases de développement, ce qui contribue à la rédaction de demandes d'autorisation de mise sur le marché de grande qualité.
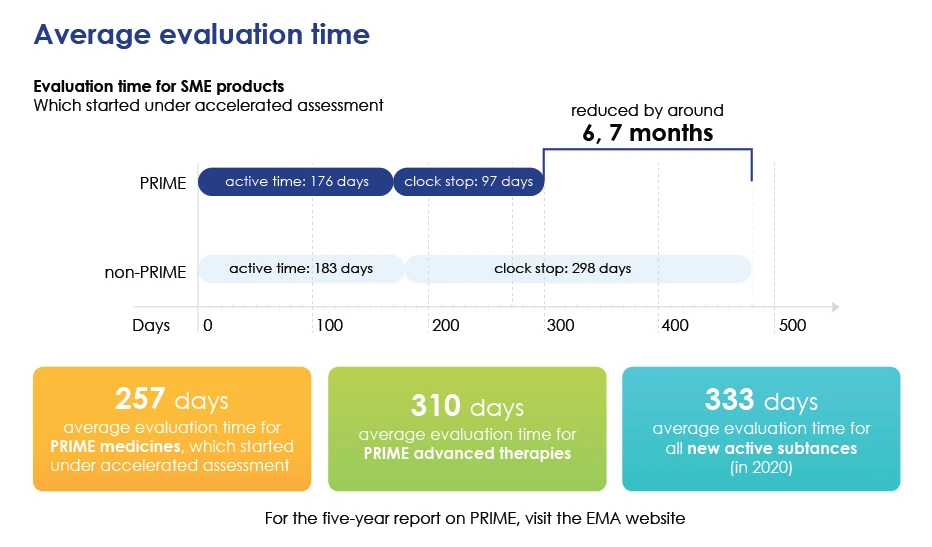
- Accélère l'évaluation globale en réduisant le temps moyen d'évaluation afin que les médicaments puissent reach plus rapidement reach .
- Aide les innovateurs à concentrer leur attention sur le développement de médicaments destinés à améliorer les résultats pour les patients et à répondre à leurs besoins non satisfaits.
Le temps d'évaluation en détail
Applications pour le parcours PRIME
La voie PRIME donne la priorité aux besoins médicaux non satisfaits. Sur les 384 demandes PRIME reçues depuis mars 2016, seules 18 ont abouti à une autorisation de mise sur le marché en juin 2021.

Êtes-vous prêt pour PRIME ?
L'existence de la filière PRIME est due à d'importants besoins médicaux non satisfaits et à la volonté du Réseau européen de réglementation des médicaments (EMRN) de combler les lacunes. Pour évaluer la pertinence d'un produit pour la voie PRIME, il faut prendre en compte les éléments suivants :
- Résultats : Les candidats doivent énoncer le besoin médical non satisfait et fournir un argument convaincant sur la manière dont leur produit répondra à ce besoin.
- Potentiel : Les candidats doivent démontrer le potentiel bénéfique de la thérapie dans les critères de besoins médicaux non satisfaits.
- Données précliniques : Les demandeurs doivent présenter des données sur l'efficacité ou les performances de la thérapie dans le système biologique humain. Les modèles non cliniques, même s'ils sont précis, ne donnent pas un aperçu exact de leur comportement dans le système biologique humain.
- Stade de développement : Le demandeur doit identifier le bon stade pour entrer dans le parcours PRIME afin d'obtenir des conseils optimaux de la part des régulateurs et de poursuivre la demande.
Afficher la subvention PRIME
Une fois qu'un demandeur s'est vu accorder la possibilité d'emprunter la voie facilitée, EMA
- Désigner un rapporteur issu du Comité des Produits médicaux usage humain (CHMP) ou du Comité des thérapies innovantes (CAT) dans le cas des thérapies innovantes.
- Organiser une réunion de lancement avec le rapporteur du CHMP/CAT et un groupe multidisciplinaire d'experts afin de fournir des conseils sur le plan de développement global et la stratégie de réglementation.
- Désigner un point de contact unique pour le demandeur.
- Fournir des avis scientifiques à chaque étape clé du développement, en impliquant un ensemble supplémentaire de parties prenantes telles que les organismes d'évaluation des technologies de la santé, afin d'accélérer l'accès des patients au nouveau médicament.
- Confirmer la possibilité d'une évaluation accélérée au moment de la demande d'autorisation de mise sur le marché.
Votre demande pour la voie PRIority MEdicine est-elle prête (PRIME-ready) ? Contactez Freyr dès aujourd'hui pour en savoir plus. Découvrez comment nous pouvons vous aider dans votre stratégie réglementaire et votre désignation PRIME. Restez informé. Restez conforme.









