
Les innovations dans le domaine des combinaisons de médicaments et de dispositifs médicaux ont permis des avancées significatives dans les soins aux patients. Les médicaments associés à des dispositifs médicaux permettent une administration ciblée des médicaments, de meilleurs résultats thérapeutiques et une meilleure adhésion des patients. Toutefois, il peut s'avérer complexe de s'y retrouver dans le paysage réglementaire des combinaisons de médicaments et de dispositifs.
Ce blog explore les considérations et les défis associés aux opérations réglementaires pour les produits combinés médicament-dispositif, qui offrent des idées pour rationaliser les processus.
Vue d'ensemble et cadre réglementaire pour les combinaisons médicament-appareil
Les produits combinés médicament-dispositif mettent en synergie les effets thérapeutiques des médicaments pharmaceutiques et les capacités d'administration des dispositifs médicaux. Les combinaisons médicament-dispositif comprennent les stents à élution de médicaments, les inhalateurs et les appareils respiratoires, les patchs transdermiques, les systèmes d'administration d'insuline, les systèmes d'infusion de médicaments et les ballons enrobés de médicaments. L'administration ciblée, l'efficacité accrue, l'amélioration de l'adhésion du patient et le contrôle précis du traitement sont quelques-uns des attributs notables de ces produits.
Les autorités réglementaires telles que la Food and Drug Administration (FDAUS , l'Agence européenne des médicaments (EMA) et d'autres ont établi des lignes directrices relatives aux combinaisons médicament-dispositif. Ces dernières années ont été marquées par des évolutions notables dans le paysage réglementaire, avec un accent accru sur l'harmonisation, les évaluations fondées sur les risques et la surveillance après la mise sur le marché.
Principales considérations pour les opérations de réglementation
Lorsque l'on navigue dans les opérations de réglementation pour les combinaisons de médicaments et de dispositifs, certaines des considérations qui entrent en jeu sont détaillées ci-dessous :
Comprendre la classification des produits et les voies réglementaires
Il est essentiel de bien comprendre la classification des produits combinés médicament-dispositif et de choisir la voie réglementaire appropriée. Les fabricants doivent déterminer s'il s'agit d'une combinaison médicament-dispositif, d'un dispositif à revêtement médicamenteux ou d'un produit co. Le choix de la voie appropriée pour le type de produit spécifique est essentiel pour réussir l'accès au marché.
Répondre aux exigences scientifiques et techniques
Il s'agit notamment de garantir la compatibilité entre le médicament et les composants du dispositif, de mener des études de stabilité pour évaluer la durée de conservation du produit, de valider les processus de fabrication et de mettre en œuvre des évaluations des risques afin d'identifier et d'atténuer les dangers potentiels.
Soins aux patients et tests de convivialité
Les soins aux patients et l'ingénierie d'utilisation jouent un rôle important dans le développement de ces produits combinés. La prise en compte de facteurs tels que l'interface utilisateur, l'ergonomie, la manipulation du dispositif et l'adhésion du patient pendant le développement du produit permet de garantir une utilisation sûre et efficace par les patients et les professionnels de la santé avec un minimum d'erreurs.
Considérations postérieures à la mise sur le marché
Les obligations post-commercialisation constituent un aspect essentiel de la conformité réglementaire pour les combinaisons médicament-dispositif. Les fabricants doivent mettre en place des processus de notification des événements indésirables, de surveillance post-commercialisation et de notification de vigilance afin de contrôler la sécurité et les performances de leurs produits.
Se tenir au courant des dernières lignes directrices et mises à jour réglementaires
Il est essentiel de se tenir informé des dernières directives et mises à jour afin de garantir la conformité et d'aligner les stratégies réglementaires sur les attentes actuelles. Le paysage réglementaire des combinaisons médicament-dispositif évolue constamment. Se conformer aux directives FDA, du règlement européen sur les dispositifs médicaux (MDR) et du Conseil international d'harmonisation des exigences techniques pour l'enregistrement des produits pharmaceutiques à usage humain (ICH) peut aider les fabricants à rester en conformité.
Meilleures pratiques pour rationaliser les opérations réglementaires
Pour optimiser les opérations réglementaires relatives aux associations médicamenteuses, les entreprises pharmaceutiques peuvent suivre les meilleures pratiques illustrées dans le diagramme à secteurs ci-dessous :
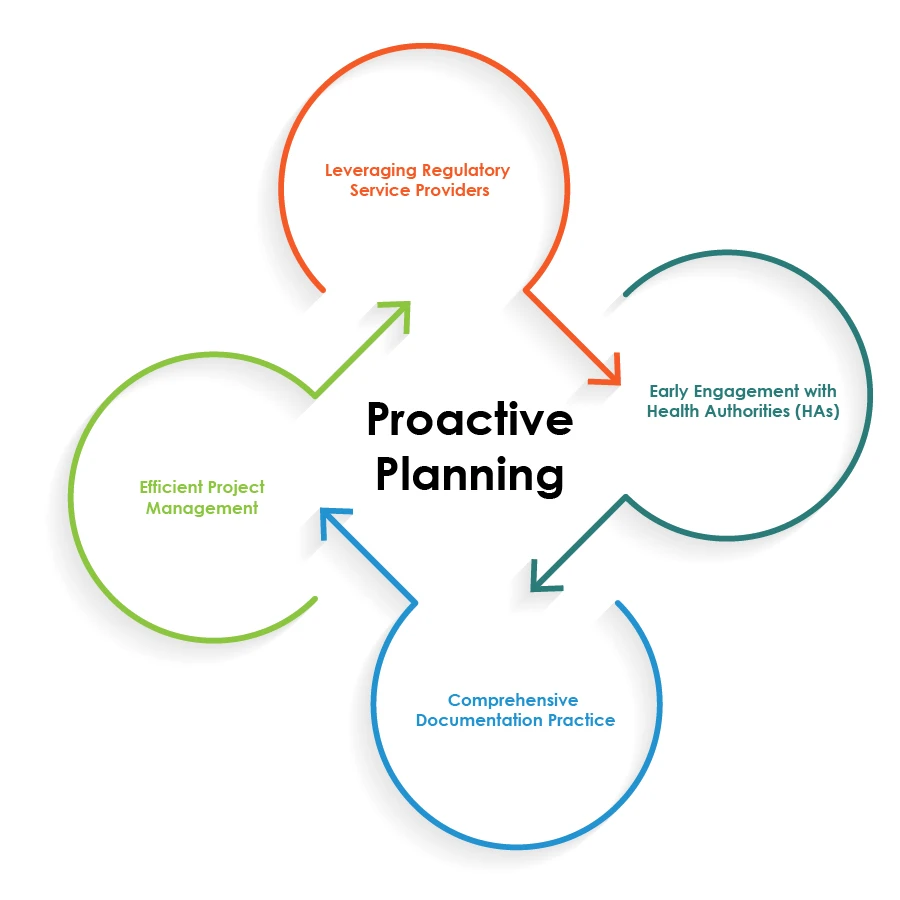
La planification proactive est la pierre angulaire d'une combinaison médicamenteuse sans faille Opérations réglementaires
Tendances et défis futurs
Il est essentiel pour les entreprises pharmaceutiques et les professionnels de la réglementation impliqués dans les opérations de réglementation de ces produits de garder un œil sur les tendances et les lacunes à venir. Voici quelques tendances et défis à surveiller :
- Technologies émergentes : Les nanotechnologies, l'impression 3D et les applications connexes influencent le développement de combinaisons médicamenteuses innovantes. Ces tendances technologiques permettent une administration ciblée des médicaments, une médecine personnalisée et un meilleur suivi des patients. Cependant, elles posent également des défis réglementaires uniques en matière de sécurité, d'efficacité et de contrôle de la qualité.
- Cybersécurité : Avec la connectivité croissante des dispositifs médicaux, il est primordial de garantir la sécurité des données et de se protéger contre les cybermenaces. L'intégration de mesures de cybersécurité solides et la mise à jour des meilleures pratiques en matière de sécurité des dispositifs sont des considérations essentielles pour les activités de réglementation.
- Défis divers : Il s'agit notamment des complexités de la chaîne d'approvisionnement mondiale, telles que l'approvisionnement en matières premières, la disponibilité des composants et les processus de fabrication, qui posent des problèmes pour maintenir la conformité réglementaire et garantir la qualité des produits. Des pratiques robustes de gestion de la chaîne d'approvisionnement, d'évaluation des risques et de surveillance des fournisseurs sont essentielles pour relever ces défis et atténuer les risques associés.
Pour s'y retrouver dans le paysage réglementaire des produits combinés médicaments-dispositifs médicaux, il faut avoir une compréhension approfondie du cadre réglementaire, des directives récentes et des meilleures pratiques. Prendre en compte les considérations clés, se tenir au courant des changements et mettre en œuvre les meilleures pratiques aidera les entreprises pharmaceutiques à rationaliser leurs opérations réglementaires. La collaboration avec des prestataires spécialisés dans le domaine réglementaire permet aux entreprises de tirer parti de connaissances et d'expériences spécialisées et d'optimiser leurs chances de réussite réglementaire dans ce domaine en constante évolution et exigeant. Grâce à notre expertise éprouvée en matière de respect des normes réglementaires mondiales, Freyr peut vous aider à garantir la conformité de vos produits tout au long de leur cycle de vie. Pour en savoir plus, us.









