
Afin d'améliorer l'accessibilité des médicaments innovants pour les patients au Royaume-Uni après le Brexit, une nouvelle procédure d'autorisation accélérée, connue sous le nom d'Innovative Licensing and Access Pathway (ILAP), a été lancée en janvier 2021. Son objectif principal était de fournir une feuille de route intégrée à toutes les parties prenantes afin d'améliorer le processus de développement des produits. L'ILAP soutient en outre les développeurs commerciaux et non commerciaux en facilitant l'accès des patients aux médicaments innovants grâce à une réduction des délais de mise sur le marché. Les entreprises pharmaceutiques peuvent envisager l'ILAP comme une voie à suivre une fois que les données non cliniques ont été consolidées. Il s'applique aux nouvelles entités chimiques (NCE), aux médicaments biologiques, aux nouvelles indications et aux médicaments réutilisés.
L'ILAP est une initiative développée conjointement par l'Agence de réglementation des médicaments et des produits de santé (MHRA) en association avec le Centre thérapeutique et toxicologique du Pays de Galles (AWTTC), l'Institut national pour l'excellence en matière de santé et de soins (NICE) et le Consortium écossais des médicaments (SMC) en tant que partenaires permanents. Parmi les partenaires qui soutiennent l'ILAP figurent le National Health Service England (NHS), la Health Research Authority (HRA) et le National Institute for Health Research (NIHR). Ensemble, les parties prenantes apportent une contribution accrue sur les plans réglementaire, scientifique, éthique et commercial au stade précoce du développement des médicaments, pendant les essais cliniques.
Selon Freyr, l'ILAP offre de formidables opportunités aux développeurs de traitements innovants, en particulier à ceux qui répondent aux besoins non satisfaits des patients. Pour un coût relativement modeste (environ 8 000 £), une entreprise peut obtenir des conseils dès les premières étapes, obtenir une désignation pour son produit et convenir d'un profil de développement cible. Cela peut permettre de gagner un temps considérable sur l'ensemble du cycle de développement du produit. Il est également avantageux de ne pas se limiter à l'autorisation de mise sur le marché et de se préparer dès le début aux négociations sur le remboursement.
L'ILAP soutient favorablement la comparaison avec des programmes similaires proposés au sein du réseau européen des médicaments (tels que le PRIME). Bien que différent dans son concept et sa mise en œuvre, l'ILAP a des critères d'acceptation plus larges et un taux d'acceptation plus élevé. L'ILAP offre également une voie d'intégration avec le projet Orbis de la Food and Drug Administration (USFDA) des États-Unis pour les produits oncologiques émergents.
Comment poser sa candidature à l'ILAP ?
Pour accéder à l'ILAP, les candidats doivent demander un passeport innovation (IP). L'obtention d'un IP permet aux développeurs de médicaments d'accéder à la procédure sur la base des preuves requises pour qu'un produit soit conforme aux critères d'éligibilité définis par le NICE, le SMC, l'AWTTC et la MHRA.
Cette désignation agit comme un catalyseur pour les produits innovants, de la phase préclinique à la phase de développement intermédiaire. La PI peut conduire à la définition d'un profil de développement ciblé (TDP). Le TDP est une feuille de route qui facilite l'accès aux partenaires de l'ILAP à des stades précoces du cycle de développement des médicaments, afin d'accélérer l'accès des patients à des traitements nouveaux et innovants. Les patients font partie intégrante de ce processus. Plusieurs outils fournis par l'ILAP aident les demandeurs à toutes les étapes de la conception, du développement et du processus d'approbation.
Critères de désignation des passeports innovants
MHRA clarifient les critères d'attribution du statut de produit innovant. Cela concerne particulièrement les produits innovants et se compare favorablement aux programmes équivalents proposés en Europe.
À l'avenir, l'applicabilité spécifique de la propriété intellectuelle aux dispositifs médicaux et aux produits combinés, domaines dans lesquels l'innovation est toujours importante, peut s'avérer bénéfique.
La désignation du PI est évaluée par les partenaires permanents et les partenaires de soutien sur la base des critères suivants :
- Critère 1 : Détails de l'affection, du patient ou de la zone de santé publique
- Pour les affections graves et potentiellement mortelles
- Dans un cas où le besoin est crucial pour les patients
- Critère 2 : Le médicament répond à un ou plusieurs domaines spécifiques, notamment
- Médecine innovante
- Médicaments associés à une nouvelle indication
- Médicaments pour les maladies rares
- Médicament en cours de développement pour l'objectif de santé publique du Royaume-Uni
- Critère 3 : Le médicament a le potentiel d'offrir
- Une brève description de la manière dont le médicament ou l'indication proposé sera bénéfique pour les patients.
- Les points de vue des patients ou des organisations de patients sont encouragés.
Lors du dépôt de la demande de propriété intellectuelle, une réunion entre les demandeurs et la MHRA lieu afin de déterminer si le produit répond aux trois (03) critères.
Selon les dernières informations disponibles en janvier 2022, la MHRA reçu soixante-et-onze (71) demandes, dont quarante-et-une (41) ont abouti à la désignation IP, vingt-deux (22) sont en cours de traitement et sept (07) ont été rejetées.
Le moment opportun pour entrer dans l'ILAP est mentionné ci-dessous.
- Au stade du développement initial ou intermédiaire du produit
- Lorsque des données pertinentes sont disponibles
- Lorsque les demandeurs ressentent le besoin d'obtenir des informations de la part des parties prenantes
- Les candidats aspirent à adopter de nouvelles approches innovantes
- Pas lorsque le produit se trouve à la fin de la phase de développement.
Aperçu du développement des médicaments
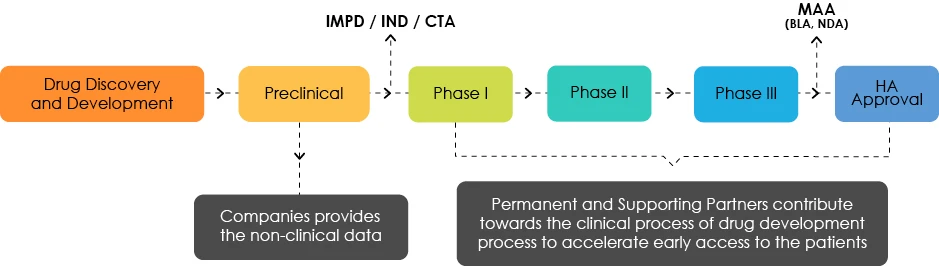
Comprendre le profil de développement cible (PDC)
Les experts du TDP analysent les caractéristiques des produits et mettent en évidence les lacunes d'un point de vue réglementaire. Ils sont chargés d'orienter les développeurs de médicaments vers une feuille de route permettant un accès rapide des patients à leurs produits.
Le TDP est un document qui est mis à jour en temps réel en fonction des exigences liées au développement du produit. Par conséquent, un produit fait l'objet de plusieurs modifications du TDP au fur et à mesure que de nouvelles données sont générées.
L'accès des patients aux médicaments essentiels peut être compromis par des retards sur le marché. Pour éviter de telles situations, les procédures accélérées jouent un rôle de catalyseur. L'ILAP est un exemple de procédure d'autorisation flexible qui est bien acceptée dans l'ensemble du secteur et qui peut accélérer le calendrier de développement des médicaments innovants. Les critères détaillés définis par le système de santé britannique permettent aux demandeurs d'explorer leur éligibilité à la désignation IP. Encourager la satisfaction des besoins cliniques et des patients non satisfaits grâce à des procédures accélérées telles que l'ILAP facilite l'entrée sur le marché et peut soulager les populations de patients à risque. Afin de protéger les intérêts des patients, les autorités sanitaires ne font aucun compromis sur la sécurité, l'efficacité ou la qualité du produit tout en garantissant un processus d'autorisation accéléré.Les services réglementaires end-to-end de Freyr facilitent le processus de documentation afin de soutenir la désignation « Innovative Passport » dans des délais accélérés, aidant ainsi vos produits à reach plus rapidement. Contactez Freyr.









