
Un nouveau rapport d'une association européenne du commerce des médicaments génériques indique que les politiques de limitation extrême des coûts peuvent avoir des effets négatifs sur la chaîne d'approvisionnement en médicaments génériques, comme la consolidation de la production de médicaments génériques et le retrait de ces produits du marché. Un récent communiqué de presse de Medicines for Europe indique en outre qu'il existe des preuves que les politiques de limitation extrême des coûts ont des effets contre-productifs sur les médicaments génériques. Le marché de l'Union européenne (UE) est également confronté à un risque de retrait de médicaments importants et moins coûteux.
Daté du 23 novembre 2021, le rapport s'appuie sur le European Commission de 2018, qui offre une protection par brevet pouvant aller jusqu'à treize (13) ans pour les médicaments innovants. Les certificats complémentaires de protection pour les ingrédients pharmaceutiques actifs (API) pour cinq (05) années supplémentaires prolongent la protection des API sur le marché européen jusqu'à vingt-cinq (25) ans au total. Pendant cette période, le prix du produit reste inchangé et celui-ci est protégé contre les produits concurrents.
Les fabricants qui privilégient l'innovation hors brevet y voient une alternative rentable. Bien que le coût total des produits hors brevet soit environ égal ou supérieur à la moitié de celui du développement d'un nouveau médicament (conception d'un médicament impliquant un processus itératif dans lequel la structure tridimensionnelle du récepteur est utilisée pour concevoir de nouvelles molécules), cette option s'avère plus avantageuse.
La plupart des fabricants de médicaments considèrent que la réaffectation des médicaments est l'option idéale pour l'innovation hors brevet. Il s'agit d'un processus dans lequel les médicaments existants sont étudiés pour identifier de nouvelles utilisations thérapeutiques. Également connu sous le nom de repositionnement de médicaments, plusieurs sociétés pharmaceutiques développent de nouveaux médicaments en utilisant cette stratégie efficace, qui permet de gagner du temps et d'économiser de l'argent.
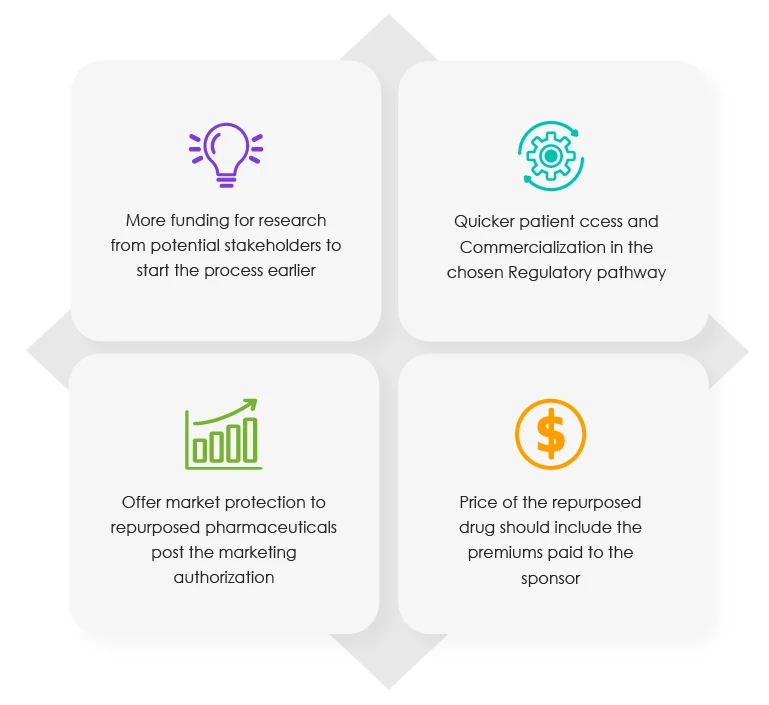
Le rapport de la Commission de 2018 contient le protocole à suivre pour le repositionnement des médicaments. Il inclut également les incitations réglementaires qui sont disponibles pour les titulaires d'autorisation de mise sur le marché (MAH) de certains produits pharmaceutiques. Selon le dernier rapport de l'association professionnelle susmentionnée, les quatre (04) avantages suivants devraient être offerts à différents stades du processus de réaffectation/repositionnement.
Mesures incitatives proposées aux promoteurs aux différentes étapes du processus de repositionnement
Afin d'encourager l'innovation hors brevet sur le marché de l'UE, de nombreux travaux ont été réalisés ces dernières années. Une équipe d'experts a notamment mis en place un cadre public-privé pour la réaffectation des médicaments. Le présent rapport fonde ses conclusions sur ce cadre qui a été lancé en octobre 2021. Il vise à tirer le meilleur parti de la source d'innovation inexploitée dans l'espace pharmaceutique pour répondre à la demande non satisfaite de médicaments vitaux.
Si vous êtes un fabricant de médicaments génériques souhaitant pénétrer le marché européen, des informations actualisées sur les dernières mises à jour réglementaires et une consultation avec un partenaire tel que Freyr vous aider à mettre en œuvre les meilleures procédures de conformité et à réaliser d'importantes économies. Restez informé. Restez en conformité.









