
FDA US FDA publié un document d'orientation qui aidera l'industrie et le personnel de l'Agence de santé (HA) à déterminer quand une modification logicielle apportée à un dispositif médical oblige le fabricant à soumettre et à obtenir FDA pour une nouvelle notification préalable à la mise sur le marché (510(k)). Ce guide vise à améliorer la prévisibilité, la cohérence et la transparence du processus décisionnel relatif au « moment de la soumission » en proposant une approche la moins contraignante possible et en décrivant le cadre réglementaire, les politiques et les pratiques qui sous-tendent une telle décision, en particulier en ce qui concerne les modifications logicielles. Découvrons en détail le FDA .
Principes directeurs et organigramme de FDA
Dans le but d'aider les fabricants de dispositifs médicaux à appliquer les principes fondamentaux, le document fournit un organigramme, des clarifications supplémentaires et des exemples nécessaires pour prendre des décisions concernant une nouvelle notification préalable à la mise sur le marché 510(k) pour une modification logicielle apportée à un dispositif déjà approuvé aux US. En outre, il convient de suivre plusieurs principes directeurs lors de l'utilisation de ces recommandations afin de déterminer s'il convient de soumettre une nouvelle notification 510(k) pour modifier un dispositif existant. Certains d'entre eux sont largement connus et découlent de la politique actuelle FDA (k), tandis que d'autres sont nécessaires pour utiliser le schéma logique mentionné dans ce guide. Conformément au guide, le schéma fourni ne peut pas couvrir toutes les subtilités possibles liées à ces modifications et leur incidence sur la décision. Par conséquent, pour déterminer la nécessité d'une nouvelle notification préalable à la mise sur le marché 510(k), les fabricants de dispositifs médicaux doivent tenir compte des principes généraux et de l'organigramme résumés ci-dessous.
- Changements affectant la sécurité ou l'efficacité d'un dispositif
- Évaluation initiale fondée sur les risques
- Conséquences involontaires des changements
- Utilisation de la gestion des risques
- Rôle des essais (activités de vérification et de validation) dans l'évaluation de la possibilité qu'un changement affecte de manière significative la sécurité et l'efficacité
- Évaluer les changements simultanés pour déterminer si la soumission d'un nouveau 510(k) est nécessaire
- Dispositif comparatif approprié et effet cumulé des changements
- Exigences en matière de documents (21 CFR Part 820)
- Soumissions 510(k) pour les dispositifs modifiés
- Détermination de l'équivalence substantielle
- La soumission d'un nouveau 510(k) est probablement nécessaire si un fabricant modifie son dispositif pour en affecter la sécurité ou l'efficacité. Toutefois, les modifications qui ne sont pas destinées à affecter la sécurité ou l'efficacité d'un dispositif doivent quand même être évaluées.
- Pour déterminer si un changement ou une modification peut avoir une incidence significative sur la sécurité ou l'efficacité, le fabricant doit d'abord procéder à une évaluation fondée sur les risques afin de déterminer si le changement peut avoir une incidence positive ou négative sur la sécurité ou l'efficacité du dispositif. Cette évaluation fondée sur les risques doit identifier et analyser tous les nouveaux risques et les changements dans les risques existants résultant de la modification du dispositif et conduire à une décision initiale sur la nécessité ou non de soumettre un nouveau 510(k).
- Il arrive que des conséquences supplémentaires non intentionnelles ou non planifiées soient déclenchées lors des soumissions de logiciels. Le diagramme de flux doit évaluer ces conséquences afin de déterminer si la soumission d'un nouveau 510(k) est nécessaire.
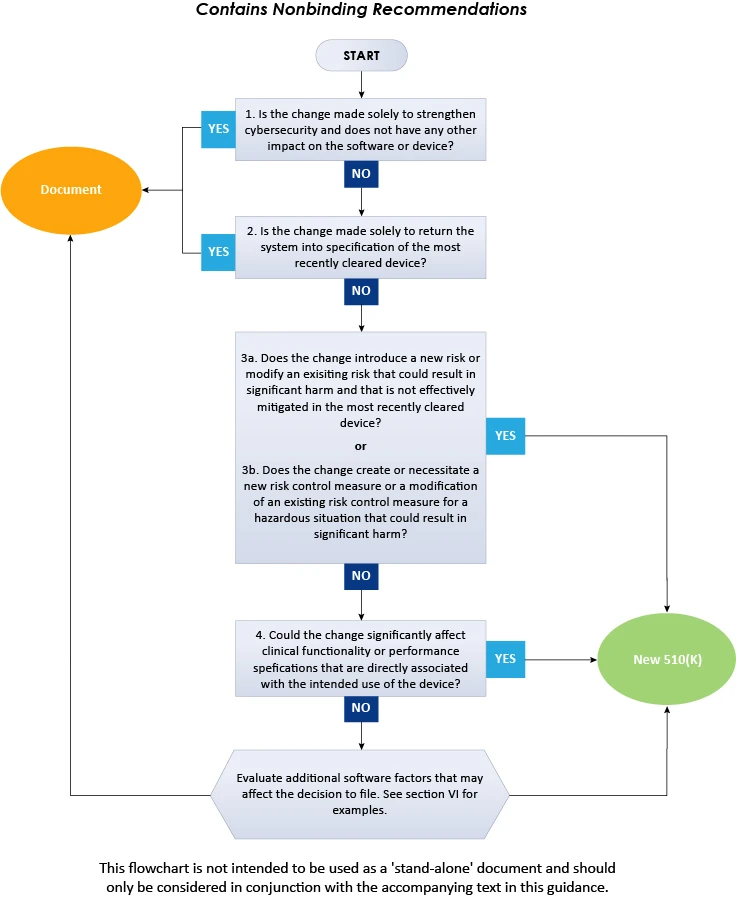
L'organigramme ci-dessus illustre la procédure étape par étape à suivre pour décider de la soumission d'une demande 510(k) pour des modifications logicielles apportées à des dispositifs existants. En conclusion, le présent guide de FDA décrit en détail l'approche à suivre par les fabricants de dispositifs médicaux pour décider si les modifications logicielles apportées à un dispositif médical existant nécessitent la soumission d'un nouveau 510(k). Pour en savoir plus sur les directives de FDA , consultez Freyr - un expert reconnu en matière de réglementation. Restez informé. Restez conforme.









