
RESPECT DE LA DATE LIMITE IDMP D'ICI JUILLET 2016 : UNE TÂCHE LOIN D'ÊTRE ANODINE
De nombreuses questions se posent concernant IDMP : où se trouvent les données au sein d'une organisation ? Le nettoyage et l'alignement des données actuelles sont-ils nécessaires ? Comment les entreprises organisent-elles ces données pour faciliter leur récupération et leur soumission ? L'organisation dispose-t-elle de processus pouvant tirer parti d'un référentiel central ?
La mise en conformité avec l'identification Produits médicaux IDMP) n'est pas une mince affaire, car elle doit tenir compte de diverses contraintes réglementaires et opérationnelles. Les organisations doivent attendre que les autorités publient leurs directives définitives et approuvent les spécifications. Dans le même temps, l'attente de ces directives risque de ne pas leur laisser suffisamment de temps pour mettre de l'ordre dans leurs affaires.
IDMP une norme complexe qui a des implications globales en matière de données et qui nécessite la collaboration et co entre de nombreuses unités interfonctionnelles. La transition offre l'occasion end-to-end les processus opérationnels et les capacités informatiques d'une organisation dans de nombreuses unités fonctionnelles. Elle contribue également à la mise en place d'un système solide de gestion du changement.
Les organisations doivent comprendre qu'une bonne architecture de l'information nécessite des efforts et du temps pour être mise en place, et doivent également reconnaître que IDMP pas simplement une version élargie XEVMPD. Il est également important de noter que ICH ne sont qu'une partie du tableau et que la disponibilité de directives régionales est essentielle. Il faut également tenir compte du fait que les mises en œuvre régionales parallèles auront des portées et des calendriers différents, avec un large éventail de contributeurs de données.
De plus, les entreprises pharmaceutiques qui souhaitent commercialiser leurs produits dans des régions réglementées doivent se IDMP à partir de 2016. EMA récemment EMA une journée IDMP IDMP IDMP et a communiqué son état IDMP et son calendrier de mise en œuvre IDMP niveau. Après avoir discuté avec l'industrie pharmaceutique et les éditeurs de logiciels, et après avoir analysé son propre système et la disponibilité de ses ressources, EMA prévu de diviser laIDMP globaleIDMP en plusieurs étapes. Ce plan sera soumis à l'approbation de European Commission CE) et, s'il est accepté, IDMP dans l'UE s'étalera de 2016 à 2018. Dans le pire des cas, si la CE n'approuve pas ce plan, il n'y a pas de plan B. Les amendes pour non-conformité peuvent atteindre 5 % du chiffre d'affaires d'une organisation ; ne pas disposer d'une bonne solution pour IDMP initiale et continue IDMP est un risque qu'aucune entreprise pharmaceutique ne peut se permettre de prendre.
IDMP: ÉLABORÉ COMME UN ENSEMBLE DE NORMES MONDIALES SOUS L'ÉGIDE DE L'ISO
Si une législation relative à l'identification des Produits médicaux doit être introduite Produits médicaux l'un des pays ISO, elle sera élaborée sur la base IDMP ISO IDMP . Une fois que les différentes régions auront adopté les IDMP , la saisie des données sera cohérente et les entreprises et les organismes de réglementation mondiaux pourront vérifier la cohérence des données entre les régions. De plus, l'utilisation d'un vocabulaire contrôlé commun facilitera grandement ce processus.
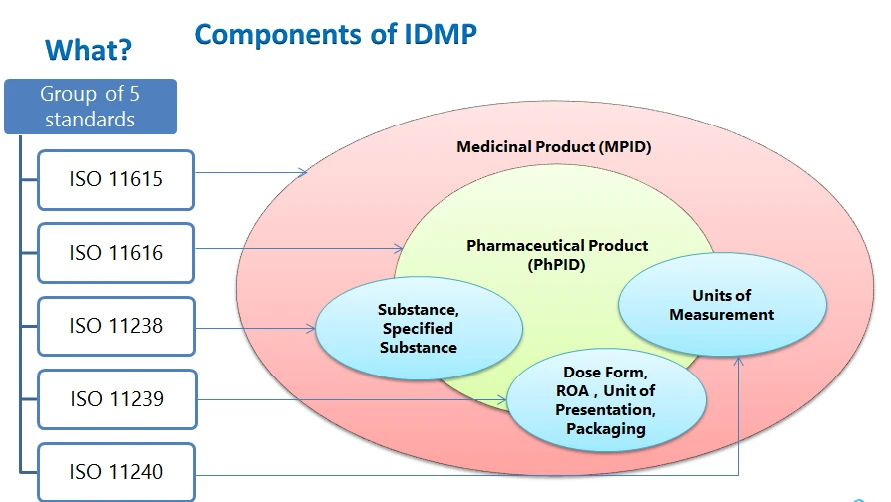
Les éléments structurels de IDMP l'identifiant du médicament, l'identifiant du produit pharmaceutique, l'identifiant de la substance, les vocabulaires contrôlés (forme posologique, voie d'administration, composants de l'emballage, unités de présentation, unités de mesure) et la description du processus de fabrication à soumettre.
IDMP
- ISO 11615 - Informations sur les médicaments
- ISO 11616 - Informations sur les produits pharmaceutiques
- ISO 11238 - Substances
- ISO 11239 - Formes posologiques pharmaceutiques, Unités de présentation, Voies d'administration et Conditionnement
- ISO 11240 - Unités de mesure
ÉTAT ACTUEL
ICH des guides de mise en œuvre et révise les normes ISO.
LES RÉGULATEURS DE L'UE SE PRÉPARENT À IDMP
- EMA entamé des travaux en collaboration avec le réseau réglementaire de l'UE afin de définir les analyses de rentabilité pour les IDMP .
- EMA en place un «Groupe IDMP ISO IDMP de l'UE recruter des experts issus EMA et du comité des données du réseau européen afin d'atteindre cet objectif. Plus précisément, il s'agira :
- Définir les éléments IDMP ISO IDMP obligatoires et facultatifs
- Définir des règles de gestion pour les éléments de données facultatifs
- Définir la conformité et les types de données
- Définir les modèles de gouvernance de l'UE
POSITION US
- Leadership actif dans la promotion IDMP auprès des organismes de réglementation mondiaux (anciennement ICH) et de l'ISO
AUTRES RÉGULATEURS
- Suisse - A l'intention de mettre en œuvre la directive après l'Union européenne (suit rapidement)
- Le Japon et le Canada ont désigné des régulateurs pour être experts au sein du groupe de travail sur la substance.
LIGNES DE TEMPS
GUIDES DE MISE EN ŒUVRE EUROPÉENS
- Les guides de mise en œuvre sont en cours d'élaboration et les guides seront disponibles à partir du premier trimestre 2016.
AUTRES
- FDA encore FDA date, mais a l'intention de faire évoluer le SPL selon les besoins.
- Japon – Situation incertaine au sein de ICH collaboration en cours avec le groupe de régulateurs et l'ISO.
- Canada - La mise en œuvre est prévue, mais il n'y a pas encore de précisions.
- Suisse - Pas encore de mise à jour
COMPRENDRE LES EXIGENCES IDMP
IDMP des informations sur Produits médicaux la forme d'un ensemble d'identifiants standard, qui s'appuient sur une hiérarchie d'identification créée lors de l'élaboration du dictionnaire des médicaments EudraVigilance (EVMPD) ou dans sa forme étendue (xEVMPD). Il y aura un chevauchement des informations avec celles enregistrées dans Structured Product Labeling (SPL) aux US dans d'autres registres de produits à l'échelle mondiale.
Cependant, IDMP de nouveaux identifiants, de nouvelles catégories et de nouvelles façons d'exprimer les relations entre les éléments du modèle de données. IDMP être intégré dans l'ADN de l'organisation, car il doit guider la construction de modèles de données dans toute votre entreprise. L'infrastructure informatique d'une organisation peut alors le reconnaître dans plusieurs systèmes, processus métier et unités fonctionnelles telles que RA, Sécurité, R&D, documentation et processus de fabrication.
DÉFIS LIÉS À IDMP
Organisationnel
- Données réparties entre plusieurs services
- Le parrainage d'un senior est nécessaire pour encourager la participation
Technique
- Découvrir, collecter et consolider des données propres
- 250 à 300 champs par produit
Co
- Gestion du changement continu
- Co entre plusieurs équipes
- Maintien de la réglementation des données par le biais de procédures internes
EN CONCLUSION :
IDMP: IMPACT SUR L'INDUSTRIE PHARMACEUTIQUE
La mise en œuvre IDMP devrait avoir un impact sur la préparation et la planification des soumissions et la gestion des données à l'échelle de l'entreprise, y compris les données de fabrication et les informations structurées sur les substances pour les informations d'enregistrement.
IDMP : GAINS D'EFFICACITÉ GARANTIS LORS DE LA MISE EN ŒUVRE
Pour que votre organisation soit prête à relever le IDMP , une coopération étroite entre plusieurs services au sein de votre organisation sera nécessaire. Un prestataire de services compétent, disposant d'un portefeuille exclusif de compétences réglementaires, peut vous aider à vous mettre en IDMP , ce qui permettra à votre organisation de saisir les nouvelles opportunités qui se présentent sur le marché.









