
Le besoin en médicaments vitaux ne cesse d'augmenter. En raison de l'apparition de nouvelles maladies mortelles, les fabricants de médicaments consacrent beaucoup de temps et d'argent à la recherche et au développement de médicaments chimiques et biologiques. Si la mise au point de médicaments innovants est un défi, leur enregistrement peut s'avérer tout aussi difficile pour les fabricants. De la préparation et la soumission de la demande d'autorisation de nouveau médicament expérimental (IND) aux demandes d'essais cliniques (CTA) et aux autorisations de mise sur le marché (MA), il existe une série de procédures réglementaires à suivre, telles que prescrites par les autorités sanitaires compétentes (HA).
Les fabricants doivent réussir du premier coup afin que les médicaments innovants reach sans retard. Cela permettra de répondre à la demande en médicaments vitaux sur certains marchés spécifiques et de garantir un retour sur investissement (ROI) aux fabricants.
Le besoin de solutions réglementaires améliorées et de processus conformes est donc crucial. Il existe plusieurs raisons pour lesquelles les fabricants ne sont pas en mesure de suivre la voie appropriée.
Défis réglementaires rencontrés par les fabricants de médicaments innovants
- Manque de compréhension des complexités de la réglementation
- Connaissance limitée des différentes étapes des soumissions à effectuer auprès des AP
- Délais de soumission des dossiers médicaux, du Common Technical Document (CTD), des rapports d'études cliniques (CSR), etc.
- Différences de réglementation lorsque les médicaments sont vendus à l'échelle mondiale
- Manque de préparation pour faire face à toute question ou difficulté survenant au cours de la phase de fabrication
Avantages de la collaboration avec le bon fournisseur de services/solutions réglementaires :
Le bon partenaire veillera à ce que toutes les étapes de la fabrication des médicaments soient conformes aux exigences des organismes de réglementation concernés et aboutissent à des soumissions dans les délais.
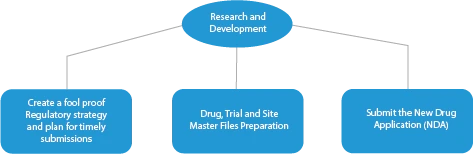
La fabrication d'un médicament innovant comporte quatre (04) étapes. Elles sont les suivantes :
- Recherche et développement
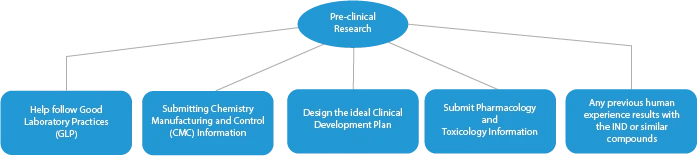
- Recherche préclinique/essais
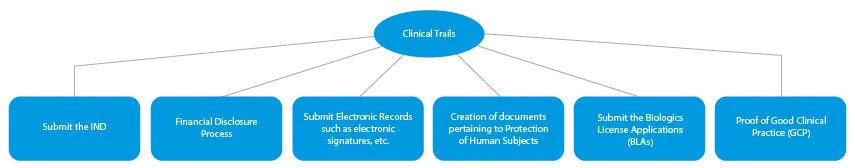
- Essais cliniques
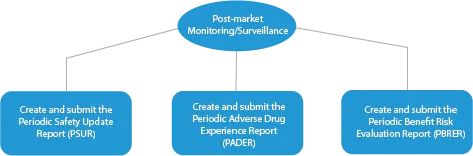
- Surveillance après la mise sur le marché
Chaque étape du développement d'un médicament nécessite une série de documents qui doivent être soumis aux autorités sanitaires. Voici une description de la manière dont un fournisseur de services réglementaires établi peut vous aider à toutes les étapes.
Le mot de la fin
Avec l'allongement de l'espérance de vie de la population mondiale, il est nécessaire de découvrir de nouveaux médicaments. L'innovation dans le domaine des sciences de la vie a conduit à plusieurs inventions de médicaments qui sauvent des vies. Beaucoup d'entre eux en sont à différents stades de fabrication. Quel que soit le stade auquel se trouve votre produit, collaborer avec un prestataire de services réglementaires mondial comme Freyr, qui possède une expertise dans l'enregistrement des médicaments innovants, peut vous aider à éviter la non-conformité et à garantir que les nouveaux médicaments reach marché à temps. Restez informé. Restez conforme.









