Au niveau mondial, les agences de santé exigent des fabricants étrangers de dispositifs médicaux et de DIV qu'ils désignent un représentant local. Au Japon, dans le cadre de la loi révisée sur les produits pharmaceutiques et les dispositifs médicaux (PMD), le système de l'ICC (In-Country Caretaker) a été remplacé par le système du MAH (Marketing Authorization Holder, titulaire d'une autorisation de mise sur le marché). Dans le cadre de ce système, les entreprises doivent obtenir une licence MAH pour obtenir l'approbation des dispositifs et les commercialiser au Japon.
Le titulaire de l'autorisation de mise sur le marché (MAH) doit être une entité locale située au Japon. Les fabricants nationaux peuvent obtenir directement la licence du titulaire de l'autorisation de mise sur le marché, tandis que les fabricants étrangers doivent identifier une entité locale pour se conformer à cette exigence du titulaire de l'autorisation de mise sur le marché.
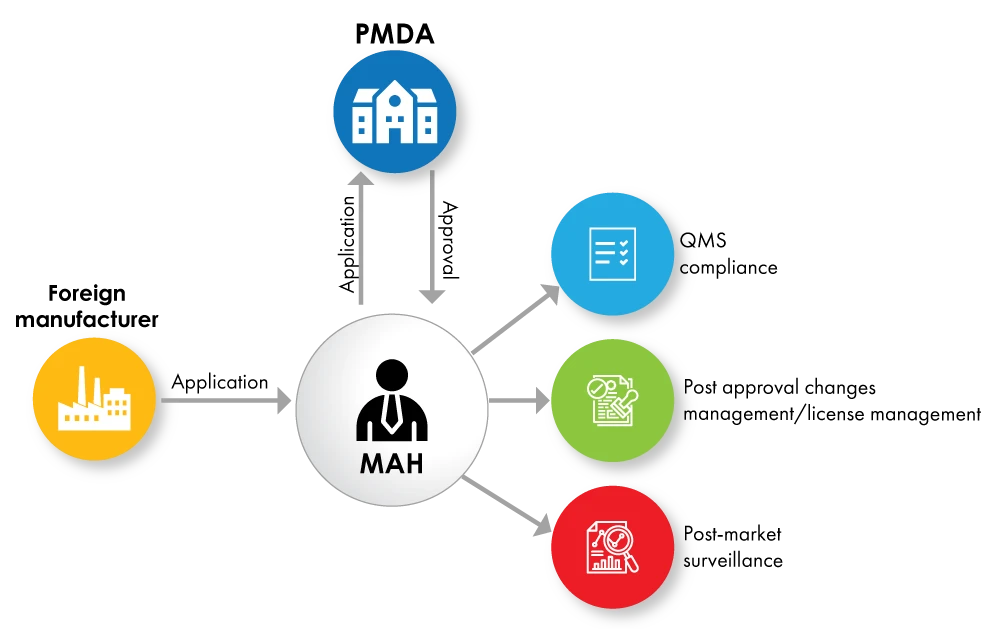
Fig. no. 1 : Organigramme de l'enregistrement des appareils avec MAH comme détenteur d'une licence
Si les fabricants étrangers ne souhaitent pas céder l'entière propriété du produit au titulaire de l'autorisation de mise sur le marché, ils peuvent nommer un titulaire désigné de l'autorisation de mise sur le marché (DMAH). Le DMAH soumet la demande au nom du fabricant étranger et l'approbation est accordée au fabricant étranger pour le dispositif.
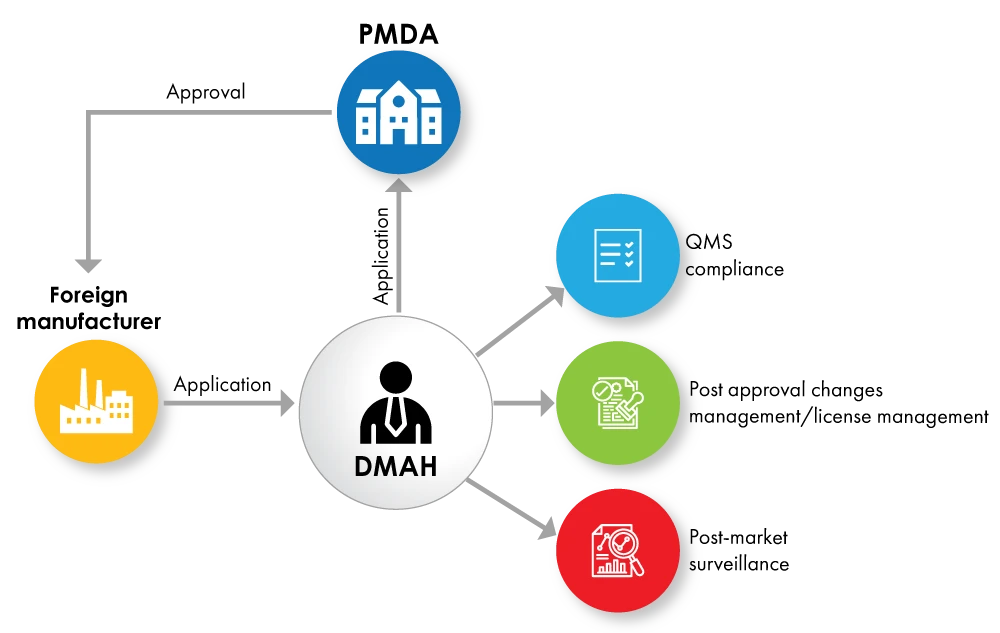
Fig. No. 2 : Organigramme de l'enregistrement d'un appareil avec le DMAH comme titulaire d'une licence
Il existe trois (03) options possibles permettant au fabricant étranger de se conformer à l'exigence PMDArelative au titulaire de l'autorisation de mise sur le marché. Les fabricants étrangers doivent évaluer minutieusement ces trois (03) possibilités. Elles comprennent :
Établir une filiale au Japon
Les fabricants étrangers peuvent créer un bureau local au Japon et agir en tant que MAH pour lancer leurs produits au Japon. Cela permet au fabricant étranger d'avoir la pleine propriété et une visibilité complète de ses produits au Japon. Cela peut ne pas être le choix préféré des petits fabricants, car les coûts liés à la création d'une filiale au Japon et au respect des exigences de qualité du ministère de la Santé, du Travail et des Affaires sociales ( MHLW) sont assez élevés.
Distributeur en tant que détenteur d'une autorisation de mise sur le marché
Il s'agit d'une solution rentable pour les fabricants étrangers qui ne disposent pas d'un bureau local au Japon. Les importateurs ou distributeurs peuvent être désignés soit comme MAH, soit comme DMAH. Compte tenu des revenus générés par les ventes d'appareils, les importateurs et distributeurs ne facturent généralement pas de frais supplémentaires pour agir en tant que MAH ou DMAH. Les fabricants rencontrent toutefois des difficultés pour pénétrer le marché, car le distributeur agissant en tant que MAH peut se montrer réticent à délivrer un certificat de non-objection (NoC) à d'autres distributeurs. Il arrive parfois que les distributeurs refusent de coopérer avec le fabricant étranger pour changer de MAH et transférer la licence du dispositif au nouveau MAH/DMAH désigné.
Alliance avec des tiers
Les fabricants étrangers peuvent désigner un prestataire de services tiers indépendant comme MAH/DMAH. La confidentialité du dispositif est bien protégée et le fabricant étranger contrôle la propriété légale du produit. Les fabricants peuvent mettre en œuvre et réaliser leurs plans d'expansion du marché.
Responsabilités du titulaire de l'autorisation de mise sur le marché
Un MAH/DMAH agit en tant que représentant au nom du fabricant étranger et contribue à l'approbation des dispositifs au Japon. Les principales responsabilités d'un MAH/DMAH sont les suivantes :
- Homologation End-to-end
- Veiller à ce que des dispositifs sûrs et de qualité soient introduits sur le marché japonais en gérant correctement la fabrication et le contrôle de la qualité des produits.
- Être responsable de la mise à disposition du dispositif à la partie titulaire d'une licence de vente/distribution de dispositifs médicaux.
- Gestion Post-Market Surveillance (PMS)
Étant donné que le MAH/DMAH doit respecter toutes les mesures de sécurité, Quality Management System (QMS) et les bonnes pratiques de vigilance (GVP) au nom du fabricant étranger, il est extrêmement important de choisir le bon MAH/DMAH. Par conséquent, les fabricants étrangers doivent évaluer minutieusement toutes les options avant d'opter pour le meilleur modèle MAH possible. Ils doivent notamment réaliser une analyse de faisabilité, déterminer le RoI, les relations avec les importateurs et les distributeurs, le budget disponible, la taille du portefeuille, les bénéfices liés à la vente des dispositifs, les délais de lancement des dispositifs, etc. Les fabricants doivent choisir avec soin s'ils souhaitent céder la propriété des dispositifs au MAH ou nommer un DMAH et conserver la propriété.
Pour en savoir plus sur les exigences MAH/DMAH au Japon, reach un expert en réglementation chez Freyr. Restez informé. Restez en conformité.









