
Dans le paysage hautement réglementé de l'industrie des sciences de la vie, le respect des lignes directrices spécifiques aux produits (LDSP) est primordial pour la réussite du développement et de l'approbation des médicaments. Ces lignes directrices sont des documents détaillés publiés par les autorités sanitaires mondiales afin de fournir des conseils pour l'approbation des produits pharmaceutiques dans des catégories thérapeutiques spécifiques.
Ce blog détaille l'objectif, la pertinence et le point de vue de l'AP sur la publication des PSG. Cet artefact permet de comprendre la raison d'être et les attentes énoncées dans les PSG qui permettent la réussite stratégique des entreprises des sciences de la vie.
Comprendre les lignes directrices spécifiques aux produits et leurs types
Les PSG jouent un rôle essentiel dans l'élaboration de la voie réglementaire pour les produits pharmaceutiques. En fournissant des orientations ciblées, les AP garantissent la cohérence et des évaluations solides des demandes de produits dans des catégories thérapeutiques spécifiques. En adhérant aux PSG, les entreprises pharmaceutiques peuvent naviguer dans le paysage réglementaire complexe, en s'assurant que leurs produits répondent aux normes de sécurité et d'efficacité requises.
Les PSG ne se limitent pas au développement de médicaments génériques. Ils couvrent également une large gamme de produits pharmaceutiques, tels que les suivants :
- Pour les médicaments innovants : Les PSG fournissent des orientations spécifiques sur les études précliniques, la conception des essais cliniques, l'évaluation de la sécurité, la pharmacocinétique et les critères d'efficacité. Elles guident les entreprises sur le type et la quantité de données nécessaires pour démontrer la sécurité et l'efficacité de leurs médicaments innovants.
- Pour les biosimilaires: Les PSG décrivent les exigences en matière de données, les méthodes d'analyse et les considérations relatives à la conception des études cliniques pour les produits biosimilaires. En les respectant, les entreprises de produits biosimilaires peuvent démontrer la similitude de leurs produits avec le produit biologique de référence, ouvrant ainsi la voie à l'approbation et à l'accès au marché.
- Pour les produits biologiques : ces lignes directrices abordent des aspects essentiels, tels que la fabrication, la caractérisation et les études de comparabilité, afin de garantir que les produits biologiques répondent aux normes approuvées.
Élaboration de lignes directrices et de processus spécifiques aux produits
L'élaboration des PSG est un effort de collaboration entre les AP, les experts scientifiques et les parties prenantes de l'industrie. Les étapes de l'élaboration d'une PSG sont les suivantes :
Étape 1 - Évaluation complète du domaine thérapeutique : Les autorités sanitaires identifient les lacunes dans les lignes directrices existantes et lancent l'élaboration de lignes directrices pour la prévention des maladies afin de combler ces lacunes. Les experts scientifiques et les parties prenantes de l'industrie sont ensuite invités à apporter leur expertise, afin de garantir que les projets de lignes directrices sont fondés sur des données probantes et pratiques à mettre en œuvre.
Étape 2 - Consultation publique: Les projets de lignes directrices sont maintenant disponibles pour examen public et commentaires. Cette approche ouverte et transparente permet aux parties prenantes, y compris les professionnels de santé, les groupes de patients et les représentants de l'industrie, de fournir des informations précieuses et d'améliorer la qualité globale et la pertinence des lignes directrices.
Étape 3Étape de révision interne: Alors que les projets de PSG sont en consultation publique, l'équipe chargée de l'élaboration des PSG au sein des AP procède à un examen interne rigoureux, afin de s'assurer que les lignes directrices répondent aux exigences réglementaires nécessaires et qu'elles s'alignent sur le cadre réglementaire général.
Étape 4 - Finalisation : Une fois finalisées, les PSG sont publiées et mises à la disposition de l'industrie, fournissant des conseils clairs et exploitables pour le développement et la soumission des produits.
Composantes des PSG
Les entreprises du secteur des sciences de la vie doivent bien comprendre les composantes des PSG. Le diagramme à secteurs suivant les illustre en détail :
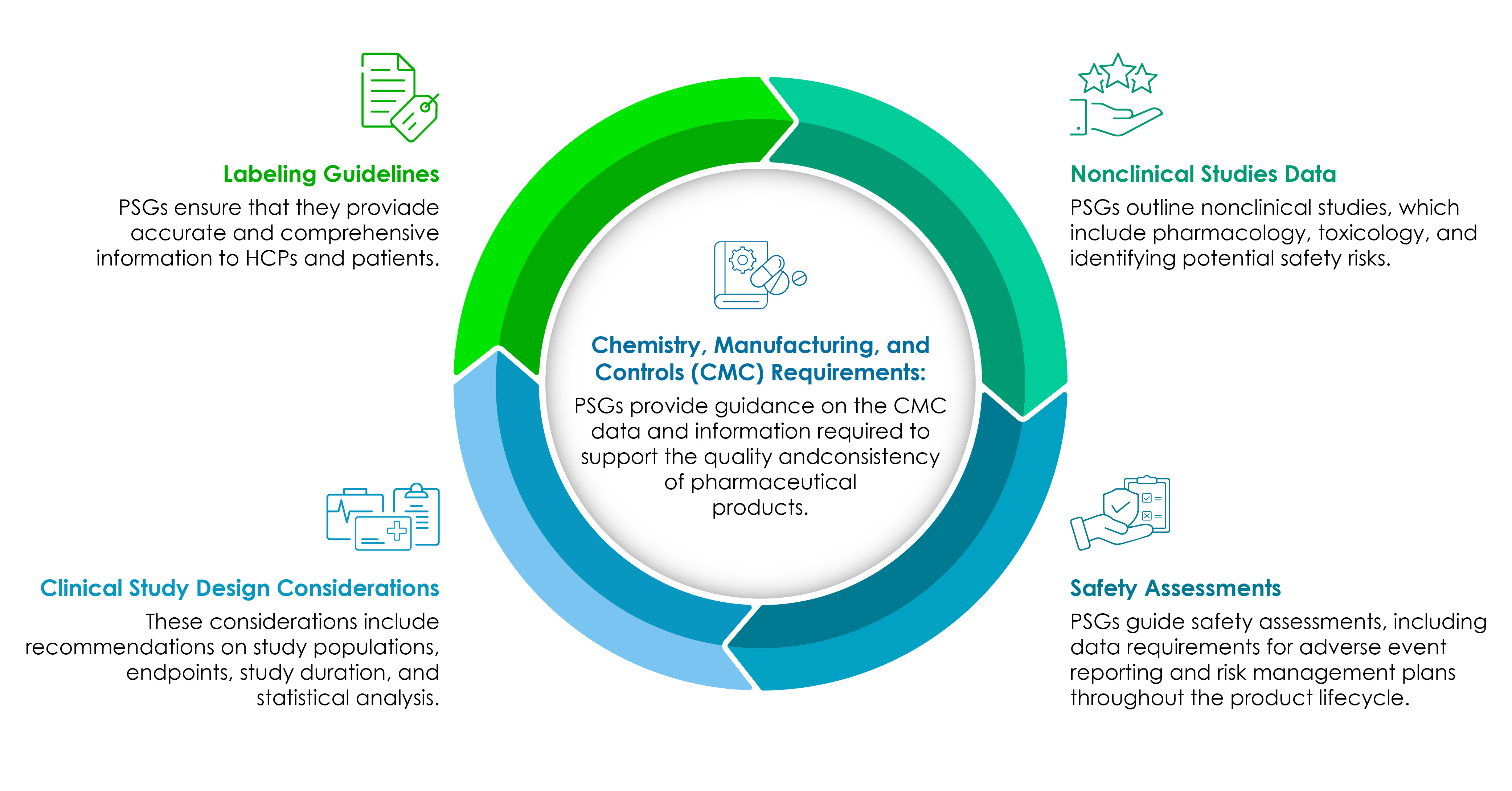
CMC au cœur de tout développement de produit pharmaceutique axé sur la réglementation.
Naviguer dans les PSG
Les points/stratégies suivants permettent de naviguer dans les PSG dans le respect de la réglementation :
- Engagement précoce avec les autorités sanitaires : Un tel engagement favorise une approche collaborative et permet d'aborder les problèmes potentiels de manière proactive.
- Expertise scientifique : L'apport d'experts permet de s'assurer que la conception des études, les méthodes analytiques et les évaluations de la sécurité sont conformes aux normes scientifiques les plus élevées.
- Consultants en réglementation: Les consultants fournissent des conseils d'experts et veillent à ce que les plans de développement et les demandes réglementaires soient couronnés de succès.
- Examen complet des PSG: Les entreprises doivent identifier les sections spécifiques des PSG applicables à leur produit et aligner leurs plans de développement en conséquence.
- Contrôle continu: Les PSG sont des documents dynamiques qui peuvent faire l'objet de mises à jour ou de révisions fréquentes. Les entreprises doivent surveiller les changements apportés aux PSG afin de garantir la conformité réglementaire avec les dernières exigences des PSG.
Conclusion
Les lignes directrices spécifiques aux produits (LDSP) constituent l'épine dorsale des soumissions réglementaires pour les produits pharmaceutiques appartenant à des catégories thérapeutiques spécifiques. Il est essentiel pour les entreprises des sciences de la vie qui cherchent à accélérer les approbations, à garantir la qualité des produits et à naviguer sans heurts dans le paysage réglementaire mondial, de comprendre le point de vue de l'AP qui sous-tend l'émission des directives spécifiques aux produits.
En tant que prestataire de services réglementaires de premier plan, Freyr l'importance de respecter les meilleures pratiques et de tirer parti de son expertise pour aider les entreprises du secteur des sciences de la vie à aligner leurs stratégies de développement de produits sur les exigences du PSG. us dès aujourd'hui pour en savoir plus sur nos services et sur la manière dont nous pouvons vous aider à atteindre vos objectifs.









