
Les produits combinés, qui intègrent des médicaments, des dispositifs et/ou des produits biologiques, ont révolutionné les soins de santé en offrant des solutions thérapeutiques innovantes. Cependant, leur nature unique présente des défis réglementaires importants. Ce guide complet explore le paysage complexe de la réglementation des produits combinés et fournit des stratégies pour naviguer avec succès dans ces voies complexes.
Comprendre les produits combinés et leur cadre réglementaire
Les produits combinés sont des produits médicaux qui associent deux (2) composants réglementés ou plus (médicaments, dispositifs ou produits biologiques) en une seule entité. Ces produits innovants peuvent prendre différentes formes, telles que des stents à élution médicamenteuse, des seringues préremplies ou des patchs transdermiques. Le cadre réglementaire applicable aux produits combinés est principalement régi par la Food and Drug Administration (FDA) aux États-Unis, et des approches similaires sont adoptées par les organismes de réglementation du monde entier.
Le Bureau des produits combinés (OCP) FDA joue un rôle crucial dans la détermination du mode d'action principal (PMOA) d'un produit combiné, qui détermine la voie réglementaire et le FDA principal FDA responsable de l'examen. Le Centre d'évaluation et de recherche sur les médicaments (CDER), le Centre pour les appareils et la santé radiologique (CDRH) et le Centre d'évaluation et de recherche biologiques (CBER) collaborent au processus d'examen, soulignant la nécessité d'une approche intégrée pour garantir la sécurité et l'efficacité des produits combinés.
Déterminer la voie de régulation
L'une (1) des étapes les plus critiques de l'élaboration d'une stratégie réglementaire pour les produits combinés consiste à déterminer la voie réglementaire appropriée. Cette décision est principalement basée sur le PMOA du produit. Voici quelques éléments clés à prendre en compte :
- Principal mode d'action (PMOA) : Identifier le mode d'action unique qui fournit l'action thérapeutique la plus importante du produit combiné.
- Affectation au centre principal : Sur la base du PMOA, le produit sera attribué au CDER, au CDRH ou au CBER pour l'examen primaire.
- Type de demande réglementaire : selon le centre principal, la demande peut prendre la forme d'une demande d'autorisation de mise sur le marché (New Drug Application,NDA), d'une demande d'autorisation de mise sur le marché d'un produit biologique (Biologics License Application,BLA) ou d'une autorisation préalable à la mise sur le marché (Premarket Approval, PMA).
- Demande de désignation (RFD) : Si le PMOA n'est pas clair, les sponsors peuvent soumettre un appel d'offres à l'OCP pour une détermination formelle.
- Pré-demande de désignation (Pre-RFD) : L'OCP peut recevoir une pré-demande de désignation afin d'obtenir un retour d'information informel et non contraignant sur des questions de classification et de compétence.
Il est essentiel de comprendre ces facteurs pour élaborer une stratégie de réglementation efficace adaptée à votre produit combiné spécifique.
Naviguer dans les procédures d'examen de précommercialisation
La procédure d'examen préalable à la mise sur le marché des produits combinés peut être complexe et nécessiter une planification et une exécution minutieuses. Voici quelques stratégies clés pour naviguer efficacement dans ce processus :
- Engagement précoce auprès des autorités réglementaires : engagez des discussions avec la FDA du processus de développement, dans le cadre de réunions préalables à la soumission. Ces interactions peuvent fournir des indications précieuses sur les exigences réglementaires, la conception des études et les défis potentiels.
- Plan de développement complet : Élaborer un plan solide qui aborde les aspects uniques de votre produit combiné, y compris la façon dont les éléments constitutifs interagissent et leurs effets combinés sur la sécurité et l'efficacité.
- Approche intégrée des essais : Concevoir des études précliniques et cliniques qui évaluent les composants individuels et le produit combiné complet. Cette approche devrait permettre d'évaluer les interactions potentielles et les effets cumulatifs.
- Considérations relatives au système qualité : mettez en œuvre un système qualité conforme aux réglementations applicables aux médicaments (21 CFR 210/211) et aux dispositifs médicaux (21 CFR 820) pour votre produit.
- Ingénierie des facteurs humains : Intégrer des études sur les facteurs humains pour évaluer les interactions entre l'utilisateur et le produit combiné, afin de garantir une utilisation sûre et efficace.
- Gestion des risques : Élaborer un plan complet de gestion des risques qui aborde les risques potentiels associés à chaque composant et à leur combinaison.
En adoptant ces stratégies, les promoteurs peuvent rationaliser le processus d'examen préalable à la mise sur le marché et augmenter les chances de succès de la réglementation.
Relever les défis de l'après-marché
Les responsabilités réglementaires relatives aux produits combinés vont au-delà de l'autorisation de mise sur le marché. Une surveillance et une conformité efficaces après la mise sur le marché sont essentielles pour garantir un succès à long terme. Envisagez les stratégies suivantes :
- Pharmacovigilance intégrée : Mettre en place un système de pharmacovigilance solide qui enregistre les événements indésirables liés aux composants du médicament et du dispositif.
- Études post-commercialisation : Planifier et mener des études post-commercialisation afin de recueillir des données supplémentaires sur la sécurité et l'efficacité, en particulier pour les nouvelles combinaisons de produits.
- Maintenance du système de qualité : Actualisez et maintenez en permanence votre système de qualité afin de garantir la conformité avec les réglementations applicables aux composants des médicaments et des dispositifs.
- Gestion des changements : Établir un processus simple de gestion des modifications post-approbation, en tenant compte de l'impact potentiel sur les aspects du produit liés aux médicaments et aux dispositifs.
- Veille réglementaire : Restez informé de l'évolution des réglementations et des documents d'orientation relatifs aux produits combinés afin de garantir une conformité continue.
En relevant de manière proactive ces défis post-commercialisation, les fabricants peuvent maintenir la conformité réglementaire et la sécurité des produits tout au long de leur cycle de vie.
Considérations réglementaires mondiales
À mesure que le marché des produits combinés se développe à l'échelle mondiale, il devient de plus en plus important de comprendre les exigences réglementaires internationales. Envisagez les stratégies suivantes pour réussir sur le plan réglementaire au niveau mondial :
- Harmonisation réglementaire : Tirer parti des efforts d'harmonisation internationale, tels que ceux déployés par l'International Medical Device Regulators Forum (IMDRF), afin de rationaliser les soumissions réglementaires au niveau mondial.
- Exigences spécifiques au marché : Rechercher et comprendre les exigences spécifiques aux produits combinés sur les marchés cibles, car les réglementations varient considérablement d'un pays à l'autre.
- Soumissions simultanées : Envisager des soumissions simultanées auprès de plusieurs agences réglementaires afin d'accélérer l'accès au marché mondial, le cas échéant.
- Essais cliniques mondiaux : Concevoir des essais cliniques qui répondent aux exigences de plusieurs agences réglementaires afin de soutenir les demandes de mise sur le marché à l'échelle mondiale.
- Partenariats internationaux : Collaborer avec des experts en réglementation ou des partenaires locaux sur les marchés cibles afin de s'y retrouver dans les réglementations spécifiques à chaque pays et dans les considérations culturelles.
En adoptant une perspective mondiale dans l'élaboration de leur stratégie réglementaire, les fabricants peuvent élargir plus efficacement leur marché reach les produits combinés.
Conclusion
Naviguer dans les voies réglementaires pour les produits combinés nécessite une compréhension globale des cadres réglementaires complexes et une planification stratégique.
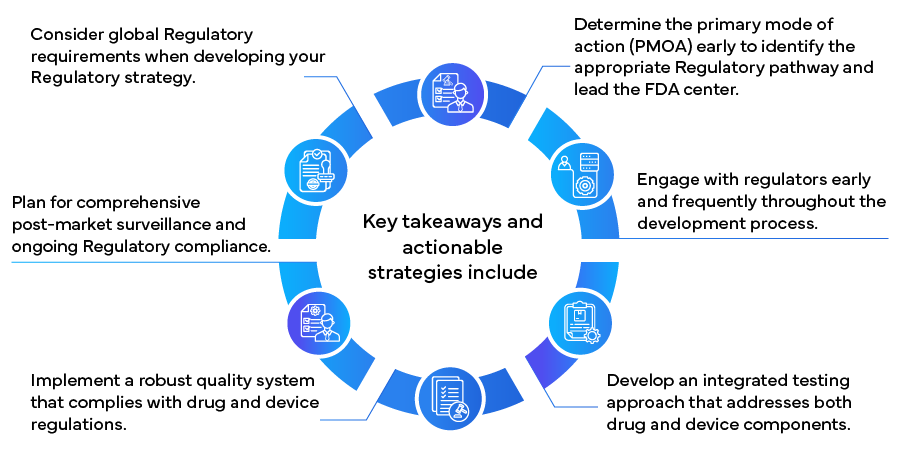
En mettant en œuvre ces stratégies, les fabricants peuvent naviguer plus efficacement dans le paysage réglementaire complexe des produits combinés, ce qui peut accélérer la mise sur le marché et garantir la conformité et le succès à long terme. Alors que le domaine des produits combinés continue d'évoluer, il est essentiel de rester informé des changements réglementaires et de maintenir une certaine flexibilité dans les approches réglementaires pour continuer à réussir dans ce secteur de la santé innovant et en pleine croissance.









