
Les autorisations d'utilisation d'urgence (EUA) jouent un rôle important dans la mise Produits médicaux plus rapide Produits médicaux vitaux pour les patients. Elles se sont avérées utiles pour faire face à des pandémies telles que celle du COVID-19. Une initiative de la Food and Drug Administration (USFDA) des États-Unis a été lancée en 2004, et l'EUA est entrée en vigueur lorsque la section 564 de la loi fédérale sur les aliments, les médicaments et les cosmétiques a été modifiée par la loi Project BioShield. Ce programme est une mesure prise par la FDA protéger la santé publique en garantissant la sécurité, l'efficacité et la qualité des produits médicaux tout en faisant face aux urgences médicales et aux menaces émergentes pour la santé publique.
us mieux cela dans les lignes suivantes.
Décoder l'AUE
La procédure EUA est un moyen de faciliter l'accès aux contre-mesures médicales en cas d'urgence déclarée. Le commissaire de la FDA autoriser les mesures suivantes dans de telles situations :
- L'utilisation autorisée de produits médicaux non approuvés.
- L'utilisation non autorisée de produits médicaux approuvés.
Les produits couverts par l'EUA comprennent les vaccins, les fluides intraveineux, les médicaments, les dispositifs, les tests, etc., et peuvent être utilisés pour diagnostiquer, traiter ou prévenir des affections potentiellement mortelles. Les produits bénéficient d'une AMUE si les critères suivants sont remplis :
- Preuve d'une maladie ou d'un état de santé mettant la vie en danger.
- Les données scientifiques fournissent suffisamment de preuves que le produit est efficace pour l'usage auquel il est destiné.
- Les avantages du produit l'emportent sur les risques (preuve de sécurité).
- Absence de produits alternatifs.
Il est conseillé aux promoteurs de se familiariser à l'avance avec les exigences FDAafin de suivre le meilleur processus réglementaire et de garantir une soumission sans erreur de l'autorisation d'utilisation d'urgence (EUA). Voici les informations obligatoires que le promoteur doit fournir dans la demande.
Données à soumettre par le promoteur à la FDA une autorisation d'utilisation d'urgence (EUA)
- Description du produit et de l'usage auquel il est destiné.
- Statut d'approbation du produit auprès de la FDA
- Informations sur la sécurité et l'efficacité, telles que les données cliniques et non cliniques, etc.
- Rapport d'analyse risques-bénéfices.
- Données relatives à la chimie, à la fabrication et aux contrôles (CMC).
- Informations sur la posologie, les contre-indications, les avertissements et les effets indésirables pour la distribution du produit médical en question.
Comment les EUA sont-ils délivrés par la FDA?
Vous trouverez ci-dessous une interprétation schématique du cycle de vie de l'EUA :
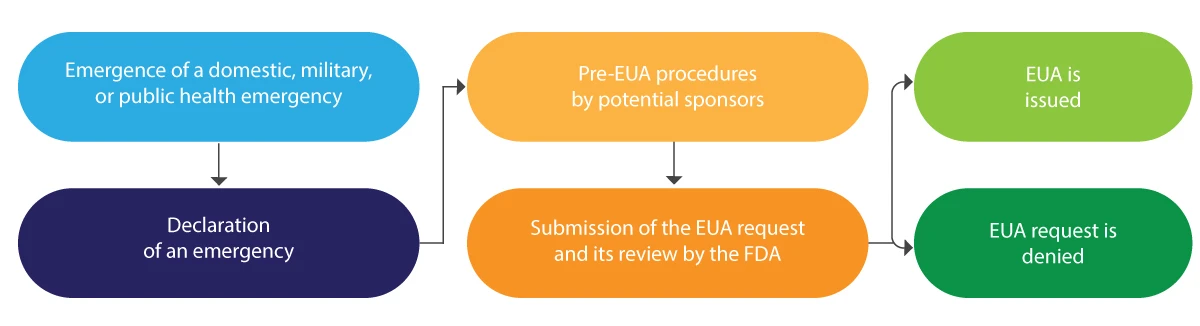
L'EUA est généralement délivrée pour une durée limitée et, à la fin de ladite situation d'urgence, elle est résiliée par la FDA
EUA et COVID-19
Le secrétaire à la Santé et aux Services sociaux (HHS) a déclaré le COVID-19 comme une pandémie le 31 janvier 2020. Depuis lors, la FDA joué un rôle déterminant dans l'autorisation de plusieurs vaccins et kits de test à domicile dans le cadre de la procédure d'autorisation d'utilisation d'urgence (EUA) afin de faire face à l'épidémie mondiale actuelle.
Avec l'émergence de nouveaux variants du COVID-19, l'ensemble de l'industrie pharmaceutique travaille d'arrache-pied pour enrayer la propagation et réduire les taux de mortalité. Il est nécessaire de disposer de nouveaux Produits médicaux d'obtenir plus rapidement leur autorisation par les autorités réglementaires mondiales afin de réduire leur délai de mise sur le marché. Selon les experts, la voie à suivre est celle de l'autorisation d'utilisation d'urgence (EUA) pour l'enregistrement de nouveaux Produits médicaux. Plusieurs autres autorités sanitaires, telles que l'Agence européenne des médicaments (EMA), Central Drugs Standard Control Organization CDSCO), Saudi Food and Drug Authority SFDA), etc., ont également mis en place la procédure d'autorisation d'utilisation d'urgence (EUA) afin d'accélérer les autorisations.
Si vous êtes un fabricant de médicaments et que vous recherchez une autorisation d'utilisation d'urgence (EUA) pour votre produit vital, vous aurez besoin d'un prestataire de solutions réglementaires compétent. Reach Freyr accélérer la mise sur le marché et garantir la conformité de votre produit.









