
Les entreprises pharmaceutiques à la recherche de nouvelles perspectives commerciales considèrent la Corée du Sud comme un marché attrayant dont l'industrie pharmaceutique est en pleine expansion. Avec plus de neuf cents (900) nouveaux médicaments en cours de développement et des exportations totalisant 3,1 milliards d'USD, la Corée du Sud offre un énorme potentiel pour la fabrication de produits pharmaceutiques de grande envergure.
En Corée du Sud, le dépôt d'une demande d'autorisation de mise sur le marché (NDA) ou d'une demande d'autorisation de mise sur le marché de produits biologiques (BLA) est une étape cruciale pour la commercialisation de nouveaux médicaments. Le ministère de la Sécurité alimentaire et pharmaceutique (MFDS) est chargé d'examiner et d'autoriser les NDA et les BLA en Corée du Sud. La procédure d'examen peut prendre jusqu'à cent quatre-vingts (180) jours, mais si le médicament est désigné comme médicament à examen prioritaire ou à procédure accélérée, elle peut être raccourcie.
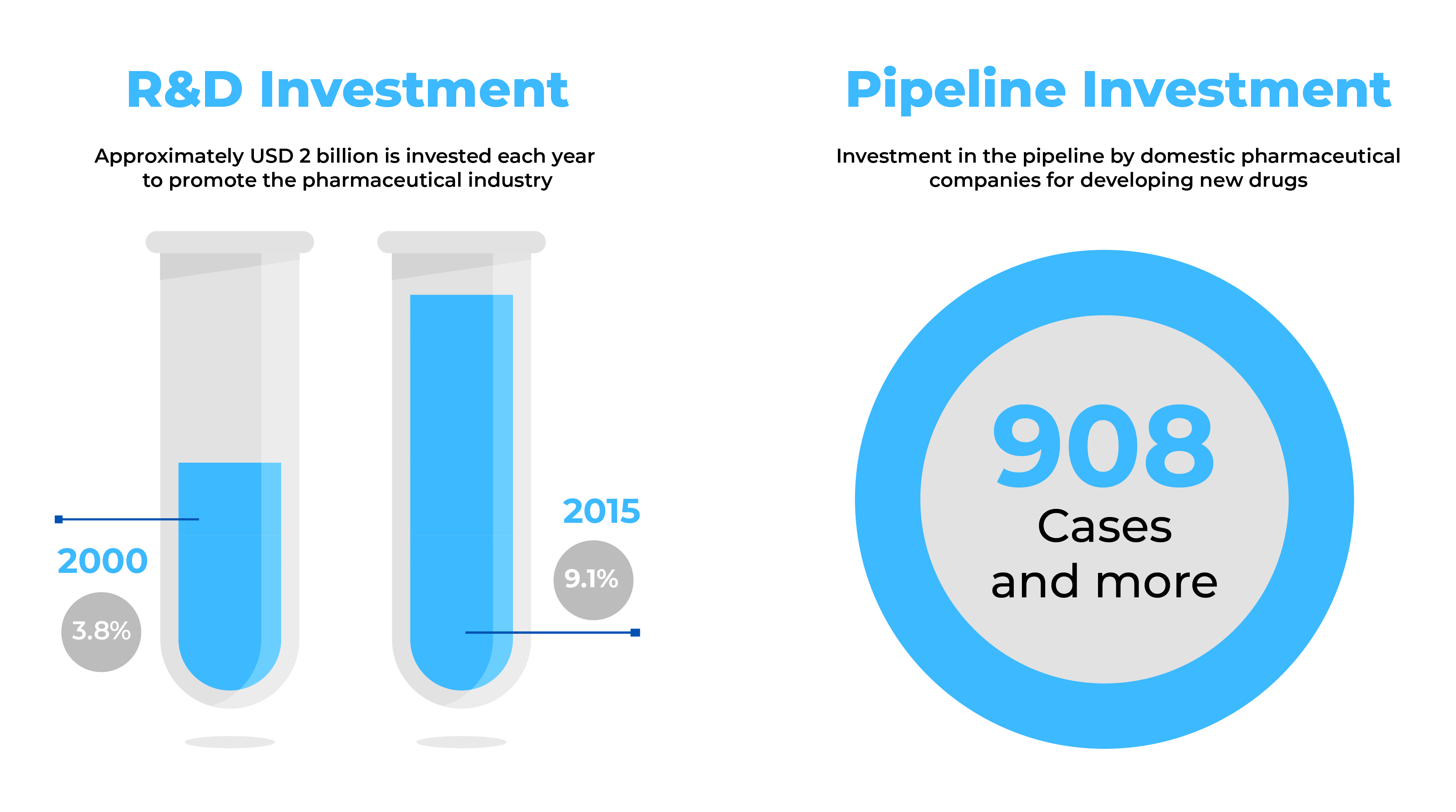
Source : Health Industry Trends-September 2014 & Global data (2017)
BLA en Corée du Sud offrent des avantages tels qu'un processus d'autorisation plus rapide, des réglementations et des exigences claires, l'intégration de données concrètes (Real World Evidence, RWE) et des exemptions pour les médicaments orphelins. Cependant, lesBLA en Corée du Sud peuvent être complexes et longues. Le processus de soumission d'une demande d'autorisation de mise sur le marché (New Drug Application,NDA) ou d'une demande de licence biologique (BLA License Application,BLA) en Corée du Sud comporte plusieurs étapes.
Voici un aperçu du processus :
- Essais précliniques : Avant qu'un médicament puisse être évalué chez l'homme, il doit d'abord être testé sur des animaux afin de s'assurer de sa sécurité et de son efficacité. En général, ces tests sont effectués sur des animaux.
- Essais cliniques : Après l'achèvement de la recherche préclinique, le médicament passe aux essais cliniques sur l'homme. Ces études sont divisées en trois (03) phases, chacune avec un plus grand nombre de participants.
- BLA : Une fois les études cliniques terminées, le promoteur peut soumettre une NDA BLA ministère sud-coréen de la Sécurité alimentaire et pharmaceutique (MFDS). Les cinq (05) modules du document technique commun électronique (eCTD), qui couvrent les données non cliniques, cliniques et relatives à la chimie, la fabrication et les contrôles (CMC), doivent être inclus dans la demande.
- Approbation : Si le MFDS détermine que le médicament est sûr et efficace, laBLA approuvée. Le médicament pourra alors être commercialisé et vendu en Corée du Sud.
Vous n'avez toujours pas répondu à toutes vos questions ?
Laissons les experts clarifier la situation.
Afin d'obtenir une perspective détaillée surBLA en Corée du Sud, Freyr prévu un webinaire gratuit avec nos experts sud-coréens. us le webinaire « Aperçu duBLA en Corée du Sud » , prévu le 29 novembre 2023 à 11h30 IST (ROW) et à 10h00 EST | 15h00 GMT | 16h00 CET (Amériques et États-Unis). Inscrivez-vous dès maintenant ! Restez en sécurité. Restez informé.
Pour les régions AMR et UE
10 : 00 AM EST | 3:00 PM GMT | 4:00 PM CET
Pour RoW
11:30 AM IST









