
Près de deux (02) décennies après la publication du premier projet de lignes directrices, la Food and Drug Administration (FDAUS a finalisé les lignes directrices sur la pharmacocinétique (PK) de population en février 2022. Le dernier projet explique l'application de la PK de population dans le développement de médicaments et formule des recommandations sur l'individualisation thérapeutique. Les lignes directrices s'appliquent aux demandes d'autorisation de nouveaux médicaments expérimentaux (IND), aux demandes d'autorisation de nouveaux médicaments (NDA), aux demandes d'autorisation de produits biologiques (BLA) et aux demandes abrégées d'autorisation de nouveaux médicaments (ANDA).
Les données issues de l'analyse pharmacocinétique de la population doivent être incluses par les promoteurs/fabricants de médicaments dans les demandes de mise sur le marché afin de simplifier les activités post-commercialisation. Elles peuvent également être cruciales pour répondre aux questions réglementaires des autorités sanitaires.
Comprendre la PK de la population
L'étude de la variabilité des concentrations de médicaments au sein d'une population de patients recevant des doses cliniquement pertinentes d'un médicament spécifique est définie comme la pharmacocinétique de population. Elle vise à identifier et à quantifier les sources de variabilité qui sont utiles pour la fabrication et la recommandation des doses de ces médicaments.
L'illustration suivante permet de comprendre l'ensemble du processus de PK :
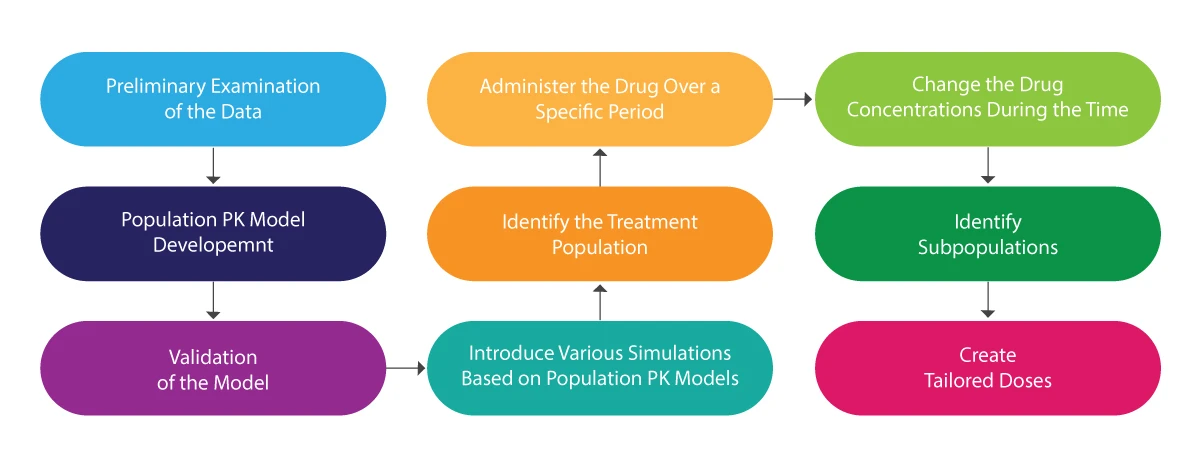
L'analyse PK de la population - Quelle est son utilité ?
- Aide à concevoir des régimes de dosage personnalisés.
- Fournit une estimation fiable de la covariable (une variable dont le changement peut être prédit dans une recherche/étude et peut être utilisée pour prédire le résultat de ladite étude).
- Il prend en compte des facteurs tels que la démographie, l'environnement, la biologie, les médicaments concomitants (autres médicaments pris par les patients pendant l'essai) et la concentration du médicament.
- Utile pour concevoir des essais cliniques plus sûrs et qualitatifs, y compris en pédiatrie.
- Obtenir la matrice d'exposition pour effectuer l'analyse exposition-réponse.
Aperçu des directives finalesFDA US sur la pharmacocinétique de population
La version finale donne un aperçu de la position actuelle FDAconcernant les données issues de l'analyse pharmacocinétique de population et les soumissions de modèles afin d'aider à la prise de décisions réglementaires. Voici un bref aperçu du projet :
Étiquetage - Il fournit des recommandations sur l'incorporation des informations pertinentes issues de l'analyse susmentionnée dans l'étiquetage. Les résultats doivent être présentés dans la section "Pharmacologie clinique" et doivent être résumés dans d'autres sections de l'étiquetage, si nécessaire.
Contenu - Le contenu et le format à respecter pour la soumission des rapports pharmacocinétiques de population à la FDA également été détaillés.
Prise de décision réglementaire - Les rapports PK de la population qui sont utiles pour prendre des décisions réglementaires doivent être inclus dans le module 5 du document technique commun électronique (eCTD).
Aller de l'avant
Les promoteurs qui ont besoin de conseils sur l'utilisation de l'analyse pharmacocinétique de population dans leur processus de développement de médicaments ou pour répondre à des questions réglementaires ont été invités à le faire lors de leurs réunions importantes avec l'Agence. En outre, il est impératif de garantir la bonne performance du modèle afin d'obtenir des résultats précis. Cela peut être réalisé en utilisant suffisamment de données pharmacocinétiques sur la population de patients spécifique et les sous-populations pertinentes.
Il peut être difficile pour les fabricants/promoteurs de médicaments de soumettre des rapports pharmacocinétiques précis au format eCTD et de respecter les réglementations en matière d'étiquetage. Reach à un expert en réglementation tel que Freyr, qui pourra vous aider dans vos démarches de soumission et d'étiquetage réglementaire .









