
W dniu 9 lutego 2022 r. Europejska Agencja Leków (EMA) rozpoczęła tworzenie Centrum Koordynacyjnego ds. Analizy Danych i Sieci Integracji Dane z Praktyki Klinicznej (DARWIN EU®). Jest to pierwszy krok w kierunku włączenia danych z praktyki klinicznej (RWE) do oceny leków w całej Unii Europejskiej (UE). Zapewnienie bezpieczeństwa i skuteczności leków jest podstawowym zadaniem każdej agencji regulacyjnej, a dane RWE okazują się być wiarygodnym źródłem informacji w czasie rzeczywistym, pochodzącym z globalnych baz danych dotyczących opieki zdrowotnej. Dlatego też działanie EMA celu poprawę jakości leków w regionie UE i przyspieszenie ich dostępności.
Główne działania planowane dla Centrum Koordynacyjnego DARWIN EU®
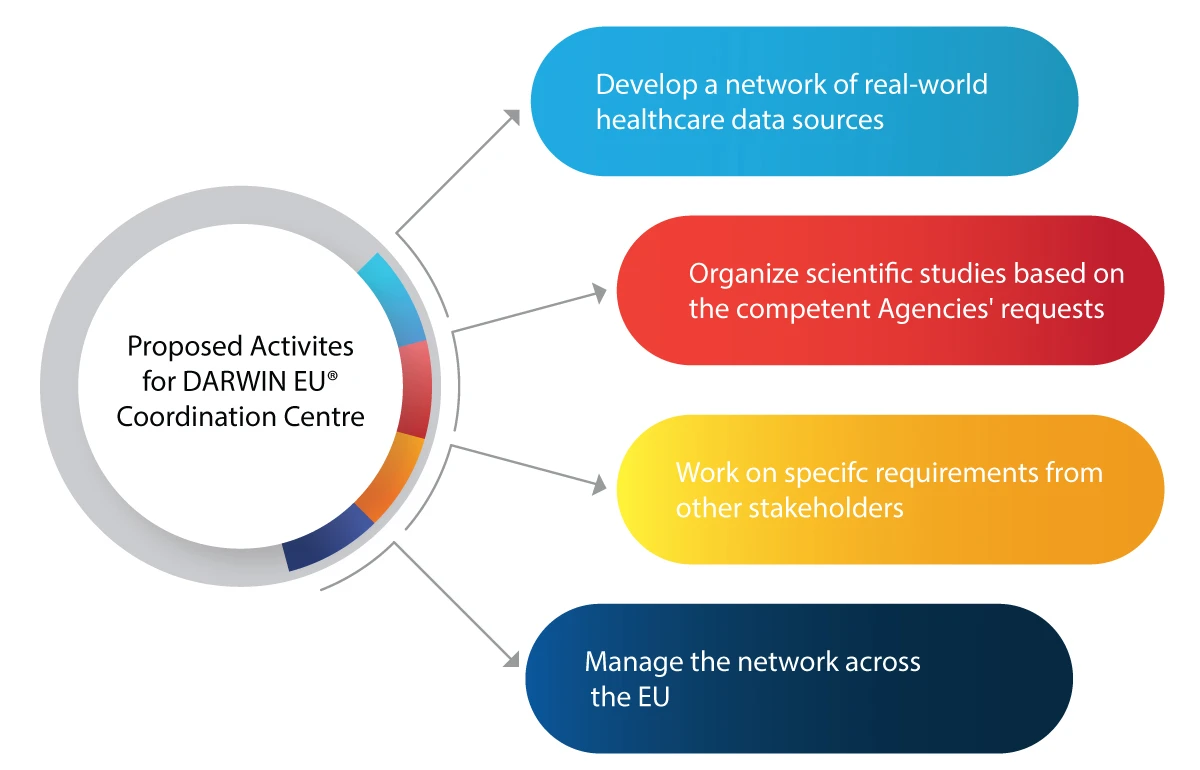
W jaki sposób DARWIN EU® pomoże EMA odpowiednim organom w obszarze regulacyjnym?
Innowacyjne leki, które są łatwo dostępne dla pacjentów, są obecnie bardzo potrzebne. Procesy regulacyjne dotyczące opracowywania, zatwierdzania, wprowadzania do obrotu i Nadzór po wprowadzeniu do obrotu dużo czasu, co powoduje, że popyt na nowe leki nie jest zaspokajany. Skrócenie czasu wprowadzania leków na rynek przy jednoczesnym zapewnieniu bezpieczeństwa, skuteczności i jakości innowacyjnych leków jest krokiem naprzód. Kilka globalnych organów ds. zdrowia dostrzega korzyści płynące z włączenia danych RWE do procesu zatwierdzania regulacyjnego, a DARWIN EU® jest inicjatywą EMA.
EMA połączyć europejską sieć regulacyjną ds. leków z europejską przestrzenią danych dotyczących zdrowia (EHDS) w celu usprawnienia wymiany danych i zwiększenia dostępu do różnych rodzajów danych dotyczących zdrowia w ramach tego programu. Ustanowi również standardy dotyczące ocen naukowych i podejmowania decyzji regulacyjnych.
Oto kilka działań, które DARWIN EU® zamierza zrealizować:
- Wykorzystanie RWE w działaniach decyzyjnych dotyczących regulacji nowych leków, szczepionek itp.
- Włączenie RWE do całego cyklu życia leku, takiego jak opracowanie, dopuszczenie do obrotu i nadzór po wprowadzeniu do obrotu.
- Przygotuj się na wszelkie przyszłe medyczne sytuacje kryzysowe, takie jak pandemie.
- Korzyści dla przemysłu farmaceutycznego dzięki wnikliwym i wiarygodnym danym RWE na temat pacjentów, chorób i stosowania leków.
- Podejmowanie świadomych decyzji regulacyjnych w oparciu o RWE w celu bezpiecznego i skutecznego stosowania leków.
- Lepsza dostępność leków ratujących życie dla potrzebujących pacjentów dzięki dokładnej i terminowej analizie danych.
Proponowane terminy uruchomienia DARWIN EU® jako w pełni funkcjonalnej sieci w UE
EMA określa EMA harmonogram pełnego uruchomienia systemu DARWIN EU®, który przedstawia się następująco:
- 2021 - Rozpoczęcie projektu
- 2022 – Utworzenie DARWIN EU®
- 2023 – Opracowanie DARWIN EU® i określenie jego zastosowań
- 2024 – Pełne uruchomienie systemu DARWIN EU®
- 2025 - Zwiększenie regulacyjnych zastosowań danych dotyczących opieki zdrowotnej poprzez zwiększenie zakresu pod względem leków, geografii itp.
EMA z Centrum Medycznym Uniwersytetu Erazma w Rotterdamie nad utworzeniem DARWIN EU®. Celem tego partnerstwa jest utworzenie centrum koordynacyjnego w celu stworzenia rozproszonej sieci danych. Obie instytucje podjęły się również zadania prowadzenia badań naukowych, wspierania procesów decyzyjnych w zakresie regulacji oraz zarządzania katalogiem rzeczywistych źródeł danych.
Co oznacza dla przyszłości uruchomienie programu DARWIN EU®?
EMA szefowie agencji ds. leków (HMA) zawsze współpracowali w celu identyfikacji wyzwań, wyznaczania celów z określonymi terminami realizacji oraz definiowania priorytetów w swoich pięcioletnich dokumentach strategicznych. Ma to na celu zapewnienie strategicznego kierunku działań prowadzonych przez europejską sieć regulacyjną ds. leków.
Uruchomienie DARWIN EU® stanowi ważny krok w kierunku realizacji strategii sieciowej EMA. Głównymi celami są prowadzenie badań naukowych w celu uzyskania odpowiedzi na pytania badawcze, wspieranie oceny leków w UE oraz utrzymywanie metadata leków. DARWIN EU® ma odgrywać ważną rolę w regulacji leków w Europie, a badania pilotażowe mają być gotowe do końca 2022 r.
Jeśli jesteś producentem leków i chcesz dowiedzieć się więcej na temat RWE oraz tego, jak wpływa ono na przyszłość procesu podejmowania decyzji regulacyjnych, skontaktuj się z Sprawy regulacyjne w firmie Freyr.









