
Therapeutic Goods Administration (TGA) w Australii ma rygorystyczne zasady rejestracji nowych leków na receptę z nowymi składnikami aktywnymi. Niedawno TGA opracowała zmieniony proces mający na celu poprawę skuteczności ratujących życie leków na receptę i szybsze udostępnianie ich pacjentom. Zmiany te dotyczą wniosków, które muszą być poparte danymi nieklinicznymi, klinicznymi i/lub danymi dotyczącymi biorównoważności (kategoria 1 i kategoria 2). TGA opublikowała w sierpniu dokument zawierający szczegółowe informacje na temat wymogów regulacyjnych w tym zakresie.
Istotne cechy nowego procesu rejestracji leków na receptę
- TGA opracowała etapowy proces rejestracji i nazwała poszczególne etapy kamieniami milowymi. Każdy z nich podąża odrębną ścieżką.
- Nowy proces ma na celu poprawę jakości dokumentacji. Dokumentacja jest przygotowywana w oparciu o wspólny format dokumentu technicznego (CTD) i jest zgodna ze wszystkimi wymogami regulacyjnymi.
- Faza planowania przed złożeniem wniosku jest ważna, ponieważ wnioskodawcy składają szczegółowe informacje na temat przyszłego wniosku. Odbywa się to co najmniej dwa i ćwierć (02 ¼) miesiąca przed złożeniem kompletnej dokumentacji. Etap ten ma pomóc TGA w ustaleniu dat kolejnych etapów i przygotowaniu zasobów do zarządzania CTD.
- Kolejnym etapem jest złożenie wniosku. Po jego zakończeniu TGA nie zezwala wnioskodawcy na przedstawianie żadnych dodatkowych danych ani informacji po dacie złożenia wniosku. Obowiązkowe jest złożenie kompletnej dokumentacji, która jest poprawna i wysokiej jakości.
- Zgodnie z sekcją 31 Therapeutic Goods Act 1989, TGA żąda dodatkowych informacji na etapie oceny. Po wstępnej ocenie wszystkie wnioski są zestawiane i wysyłane do wnioskodawcy.
Aby zrozumieć kamienie milowe w odnowionym procesie, zapoznaj się z poniższymi schematami blokowymi.
Kamień milowy 1
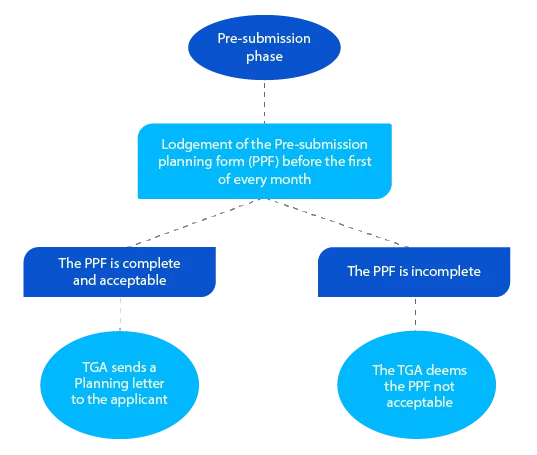
Pismo dotyczące planowania zawiera przewidywaną datę, w której TGA spodziewa się złożyć dokumentację i inne docelowe daty kluczowe dla wniosku o lek na receptę.
Kamień milowy 2
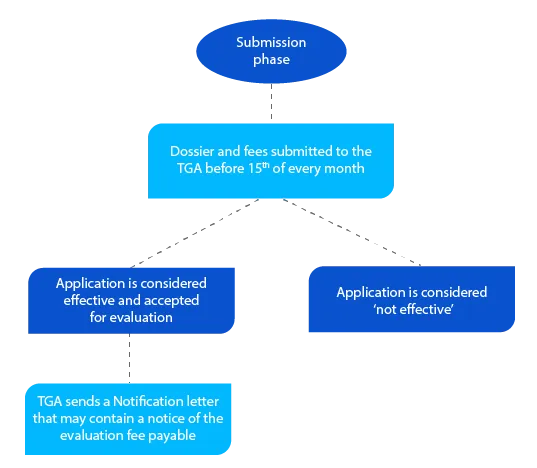
Dokumentacja zawiera informacje, które pomagają TGA ocenić wniosek, a jeśli wszystko jest akceptowalne, pismo powiadamiające jest wysyłane przed końcem miesiąca, w którym wnioskodawca złożył dokumentację.
Kamień milowy 3
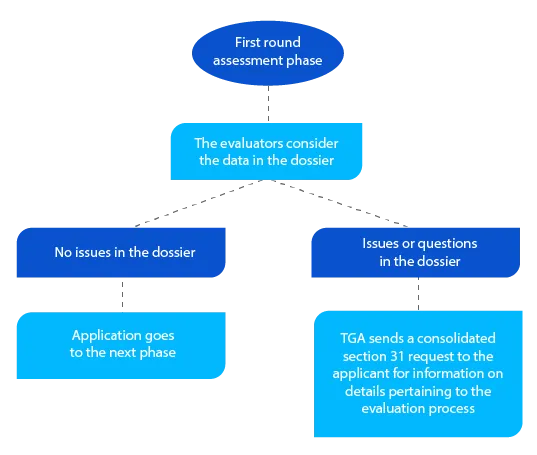
Oprócz skonsolidowanego wniosku z sekcji 31, w stosownych przypadkach, TGA przesyła kopie raportów z oceny przygotowanych przez ewaluatorów jakości, nieklinicznych, klinicznych i planów zarządzania ryzykiem (RMP).
Kamień milowy 4

Wnioskodawca może wyznaczyć czas odpowiedzi w sekcji 31. Może on wynosić trzydzieści (30) lub sześćdziesiąt (60) dni i powinien zostać wskazany w PPF. Okres ten musi zostać potwierdzony przez TGA w Planning Letter. Akceptowalnym formatem odpowiedzi jest CTD, który należy przesłać w formie papierowej i elektronicznej.
Ponieważ jest to ostatnia szansa dla wnioskodawcy na dostarczenie wszelkich brakujących informacji do TGA, należy to zrobić w sposób zgodny z przepisami.
Kamień milowy 5
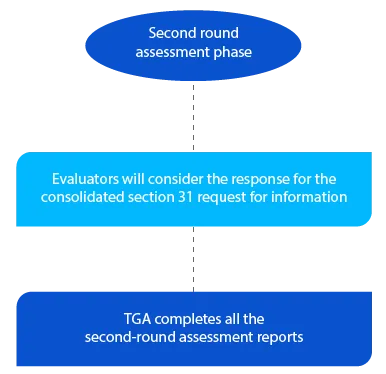
TGA ma dwa (02) miesiące w przypadku wniosków dotyczących nowych leków generycznych na drugą rundę raportów z oceny i jeden (01) miesiąc w przypadku wszystkich innych rodzajów wniosków. Raporty są wysyłane do odpowiednich wnioskodawców po zakończeniu drugiej oceny.
Kamień milowy 6
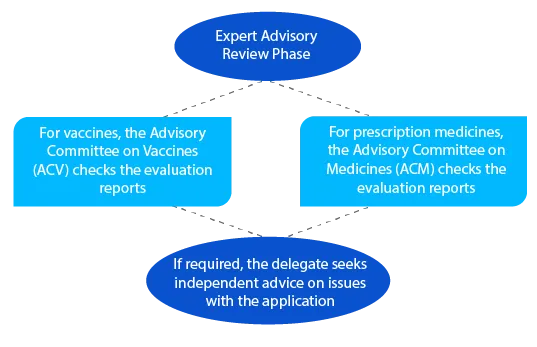
Po przeprowadzeniu przeglądu doradczego TGA wysyła powiadomienie zawierające szczegółowe informacje na temat porady otrzymanej od ACV lub ACM.
Kamień milowy 7
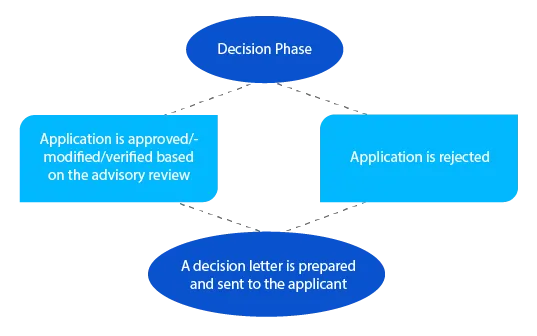
W przypadku nierozstrzygniętych kwestii, delegat może skontaktować się z wnioskodawcą na tym etapie przed podjęciem decyzji. W przypadku wniosków złożonych zgodnie z sekcją 23 Ustawy o towarach terapeutycznych z 1989 r. (nowo ocenione leki wymienione w Australijskim Rejestrze Towarów Terapeutycznych (ARTG)), powiadomienie jest wysyłane do wnioskodawcy w ciągu dwudziestu ośmiu (28) dni od podjęcia decyzji.
Kamień milowy 8
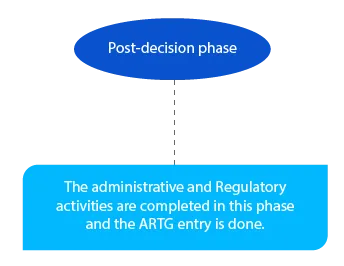
Zaległe płatności są regulowane na tym etapie. Musi to nastąpić do końca miesiąca następującego po decyzji delegata.
Ponieważ TGA podejmuje wszelkie środki ostrożności w celu zapewnienia bezpieczeństwa, skuteczności i jakości leków na receptę, jednocześnie skracając czas ich wprowadzenia na rynek, to na wnioskodawcy spoczywa obowiązek złożenia odpowiednich dokumentów, aby proces rejestracji przebiegał sprawnie. Niezależnie od etapu, idealnym rozwiązaniem jest współpraca z end-to-end dostawcą usług end-to-end , który jest ekspertem w zakresie rejestracji leków na receptę. Skontaktuj się z doświadczoną jednostką regulacyjną, aby uzyskać informacje na temat ścieżki zgodności z przepisami; bądź na bieżąco i zachowaj zgodność z przepisami.









