
Niezaspokojone potrzeby medyczne (UMN) są jednym z najpilniejszych priorytetów systemów opieki zdrowotnej. Nieustannie rozwijająca się nauka i technologia w dziedzinie opieki zdrowotnej stwarzają możliwość poszukiwania różnych opcji terapeutycznych. Organy ds. zdrowia zachęcają do stosowania innowacyjnych terapii, które mogą znacząco poprawić jakość życia pacjentów. Opierając się na priorytetowym traktowaniu innowacji i zaspokajaniu niezaspokojonych potrzeb pacjentów w zakresie opracowywania leków, Europejska Agencja Leków (EMA) wprowadziła w 2016 r. ścieżkę PRIority MEdicines (PRIME). Od tego czasu ścieżka PRIME stanowi metodę przyspieszonego zatwierdzania innowacyjnych terapii. Z tego rodzaju ułatwionej ścieżki mogą skorzystać wszystkie przedsiębiorstwa, od start-upów, przez średnie firmy biotechnologiczne, po duże międzynarodowe organizacje. Jednak kwalifikacja do tej ścieżki jest ograniczona do produktów będących w fazie rozwoju, które nie zostały jeszcze zgłoszone do Pozwolenie na dopuszczenie do obrotu produktu leczniczego procedury scentralizowanej. Kryteria kwalifikacyjne są stosowane rygorystycznie. W okresie od marca 2016 r. do kwietnia 2022 r. tylko 24% wniosków otrzymało pozytywną opinię, natomiast 72% wniosków PRIME zostało odrzuconych. Spośród 24% wniosków, które zostały wybrane do ścieżki PRIME, większość dotyczyła obszaru terapeutycznego onkologii.
Innowatorzy ubiegający się o pozwolenia na dopuszczenie do obrotu leków na rzadkie choroby lub leków sierocych często dysponują ograniczonymi zbiorami danych, które mogą służyć jako dowody na poparcie wniosków o dopuszczenie nowych leków, zgodnie z wymogami organów regulacyjnych. Wnioski dotyczące Produkty lecznicze zaawansowanej Produkty lecznicze ATMP) i leków sierocych zazwyczaj napotykają takie trudności. Ze względu na ograniczone dane dotyczące populacji pacjentów zaleca się stałą współpracę z organami regulacyjnymi, aby uzyskać lepszy wgląd w wymagania dotyczące przeglądu naukowego i zatwierdzania. Ścieżka PRIME może być przydatna w przypadku takich terapii ze względu na wczesne zaangażowanie organów regulacyjnych w zapewnianie proaktywnego wsparcia i wskazówek dotyczących gromadzenia danych oraz oceny korzyści i ryzyka.
Zalety podążania ścieżką PRIME
- Pomaga innowatorom opracować dobrze przygotowany plan rozwoju.
- Korzyści dla innowatorów dzięki zaangażowaniu organów ds. zdrowia na wczesnym etapie rozwoju; przyczynia się to do sporządzania wysokiej jakości wniosków o pozwolenie na dopuszczenie do obrotu.
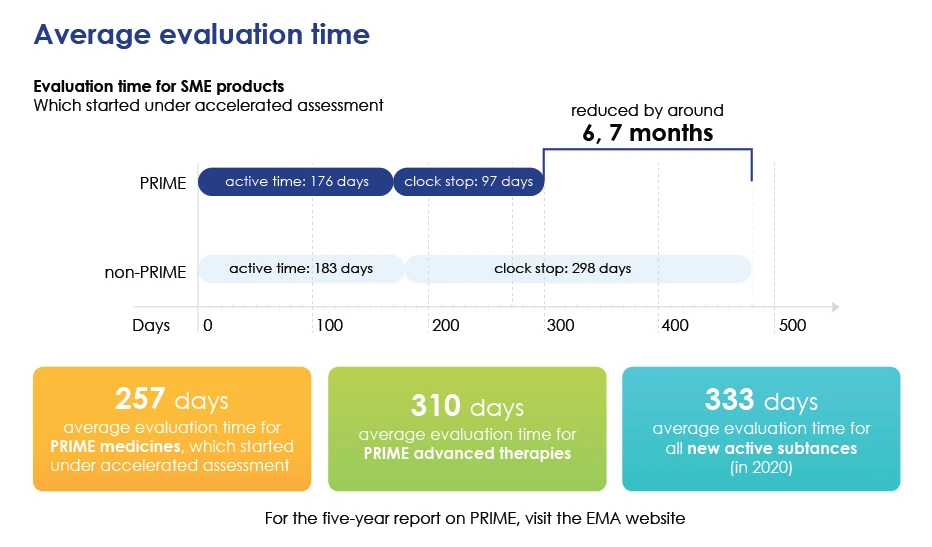
- Przyspiesza ogólną ocenę poprzez skrócenie średniego czasu oceny, dzięki czemu leki mogą szybciej reach .
- Wspiera innowatorów w skupieniu uwagi na opracowywaniu leków poprawiających wyniki pacjentów i zaspokajających ich niezaspokojone potrzeby.
Szczegółowy czas oceny
Aplikacje dla ścieżki PRIME
Ścieżka PRIME nadaje priorytet niezaspokojonym potrzebom medycznym. Spośród 384 wniosków PRIME otrzymanych od marca 2016 r. tylko 18 dotarło do etapu Pozwolenie na dopuszczenie do obrotu produktu leczniczego czerwca 2021 r.

Czy jesteś gotowy na PRIME?
Istnienie ścieżki PRIME wynika ze znacznych niezaspokojonych potrzeb medycznych i skupienia się na wypełnianiu luk przez Europejską Sieć Regulacji Leków (EMRN). Aby ocenić przydatność produktu dla ścieżki PRIME, należy wziąć pod uwagę następujące kwestie:
- Wnioski: Wnioskodawcy muszą określić niezaspokojoną potrzebę medyczną i przedstawić przekonujący argument, w jaki sposób ich produkt rozwiąże ten problem.
- Potencjał: Wnioskodawcy muszą wykazać korzystny potencjał terapii w ramach kryteriów niezaspokojonych potrzeb medycznych.
- Dane przedkliniczne: Wnioskodawcy muszą przedstawić pewne dane dotyczące skuteczności lub działania terapii w ludzkim systemie biologicznym. Modele niekliniczne, jakkolwiek dokładne, nie zapewniają dokładnego przeglądu ich zachowania w ludzkim systemie biologicznym.
- Etap rozwoju: Wnioskodawca musi określić właściwy etap wejścia na ścieżkę PRIME, aby uzyskać optymalne wytyczne od organów regulacyjnych i kontynuować aplikację.
Opublikuj dotację PRIME
Po przyznaniu wnioskodawcy możliwości skorzystania z ułatwionej ścieżki EMA :
- Wyznaczyć sprawozdawcę z Komitetu ds. Produkty lecznicze Ludzi (CHMP) lub Komitetu ds. Terapii Zaawansowanych (CAT) w przypadku terapii zaawansowanych.
- Zorganizowanie spotkania inauguracyjnego ze sprawozdawcą CHMP/CAT i multidyscyplinarną grupą ekspertów w celu zapewnienia wytycznych dotyczących ogólnego planu rozwoju i strategii regulacyjnej.
- Wyznaczenie jednego punktu kontaktowego dla wnioskodawcy.
- Zapewnienie doradztwa naukowego na każdym kluczowym etapie rozwoju, z udziałem dodatkowego zestawu interesariuszy, takich jak organy oceny technologii medycznych - w celu przyspieszenia dostępu pacjentów do nowego leku.
- Potwierdź możliwość przyspieszenia oceny w momencie składania wniosku, biorąc pod uwagę Pozwolenie na dopuszczenie do obrotu produktu leczniczego.
Czy Państwa wniosek o przyjęcie do programu PRIority MEdicine jest gotowy (PRIME-ready)? Skontaktujcie się Państwo Freyr już dziś i dokonajcie oceny. Dowiedzcie się więcej o tym, jak możemy pomóc Państwu w zakresie strategii regulacyjnej i uzyskania statusu PRIME. Bądźcie Państwo na bieżąco. Zachowajcie zgodność z przepisami.









