
Aby zwiększyć dostępność innowacyjnych leków dla pacjentów w Wielkiej Brytanii po brexicie, w styczniu 2021 r. uruchomiono nową, przyspieszoną ścieżkę zatwierdzania znaną jako Innovative Licensing and Access Pathway (ILAP). Jej głównym celem było zapewnienie wszystkim zainteresowanym stronom zintegrowanego planu działania, który usprawni proces opracowywania produktów. ILAP dodatkowo wspiera komercyjnych i niekomercyjnych twórców, ułatwiając pacjentom dostęp do innowacyjnych leków poprzez skrócenie czasu wprowadzenia ich na rynek. Firmy farmaceutyczne mogą rozważyć skorzystanie z ILAP po skonsolidowaniu danych nieklinicznych. Ma on zastosowanie w przypadku nowych substancji chemicznych (NCE), leków biologicznych, nowych wskazań i leków o zmienionym przeznaczeniu.
ILAP to inicjatywa opracowana wspólnie przez Agencję Regulacyjną ds. Leków i Produktów Opieki Zdrowotnej (MHRA) we współpracy z All-Wales Therapeutics and Toxicology Centre (AWTTC), Narodowym Instytutem Zdrowia i Doskonałości Opieki (NICE) oraz Szkockim Konsorcjum Leków (SMC) jako stałymi partnerami. Partnerami wspierającymi ILAP są National Health Service England (NHS), Health Research Authority (HRA) oraz National Institute for Health Research (NIHR). Wspólnie zainteresowane strony zapewniają lepszy wkład regulacyjny, naukowy, etyczny i komercyjny na wczesnym etapie rozwoju leków podczas badań klinicznych.
W opinii Freyr, program ILAP oferuje ogromne możliwości dla twórców innowacyjnych terapii, zwłaszcza tych, którzy zajmują się niezaspokojonymi potrzebami pacjentów. Za stosunkowo niewielką opłatą (około 8000 funtów) firma może uzyskać doradztwo na wczesnym etapie, uzyskać oznaczenie dla swojego produktu i uzgodnić docelowy profil rozwoju. Może to potencjalnie zaoszczędzić znaczną ilość czasu w całym cyklu rozwoju produktu. Korzyści płyną również z wyjścia poza Pozwolenie na dopuszczenie do obrotu produktu leczniczego wczesnego przygotowania się do negocjacji dotyczących refundacji.
Program ILAP wypada korzystnie w porównaniu z podobnymi programami oferowanymi w ramach europejskiej sieci leków (takimi jak PRIME). Chociaż różni się on pod względem koncepcji i realizacji, ILAP ma szersze kryteria akceptacji i wyższy wskaźnik akceptacji. ILAP zapewnia również ścieżkę integracji z projektem Orbis amerykańskiej Agencji ds. Żywności i Leków (USFDA) dotyczącym nowych produktów onkologicznych.
Jak zgłosić się do ILAP?
Aby uzyskać dostęp do programu ILAP, wnioskodawcy muszą złożyć wniosek o paszport innowacyjności (IP). Uzyskanie oznaczenia IP umożliwia twórcom leków dostęp do ścieżki opartej na dowodach wymaganych do spełnienia kryteriów kwalifikacyjnych określonych przez NICE, SMC, AWTTC i MHRA.
Oznaczenie to pełni rolę katalizatora dla innowacyjnych produktów od etapu przedklinicznego do etapu średniozaawansowanego rozwoju. IP może prowadzić do opracowania dokumentu określającego profil docelowego rozwoju (TDP). TDP to plan działania, który ułatwia dostęp do partnerów ILAP na wczesnych etapach cyklu życia leku, aby przyspieszyć ułatwić pacjentom dostęp do nowych i innowacyjnych metod leczenia. Pacjenci są częścią całego tego procesu. Kilka narzędzi udostępnianych przez ILAP wspiera wnioskodawców na wszystkich etapach procesu projektowania, rozwoju i zatwierdzania.
Kryteria przyznawania innowacyjnych paszportów
MHRA wyjaśniają kryteria przyznawania oznaczenia IP. Ma to szczególne znaczenie w przypadku produktów innowacyjnych, a ponadto wypada korzystnie w porównaniu z podobnymi programami oferowanymi w Europie.
W przyszłości konkretne zastosowanie własności intelektualnej w odniesieniu do wyroby medyczne produktów złożonych, czyli obszarów, w których zawsze występują znaczące innowacje, może okazać się korzystne.
Oznaczenie IP jest oceniane przez stałych i wspierających partnerów na podstawie następujących kryteriów:
- Kryteria 1: Szczegółowe informacje o stanie zdrowia, pacjencie lub obszarze zdrowia publicznego
- W przypadku zagrażających życiu i poważnych schorzeń
- W przypadku, gdy potrzeba jest kluczowa dla pacjentów
- Kryteria 2: Produkt leczniczy spełnia jeden lub więcej określonych obszarów, które obejmują
- Innowacyjna medycyna
- Lek związany z nowym wskazaniem
- Leki na rzadkie choroby
- Lek opracowywany z myślą o zdrowiu publicznym w Wielkiej Brytanii
- Kryteria 3: Lek może potencjalnie oferować
- Krótki opis korzyści, jakie proponowany lek lub wskazanie przyniesie pacjentom.
- Zachęcamy do wyrażania opinii przez pacjentów lub organizacje pacjentów.
Po złożeniu wniosku o nadanie numeru IP MHRA się spotkanie między wnioskodawcami a MHRA w celu ustalenia, czy produkt spełnia trzy (03) kryteria.
Zgodnie z najnowszymi informacjami ze stycznia 2022 r. MHRA siedemdziesiąt jeden (71) wniosków, z których czterdzieści jeden (41) zakończyło się przyznaniem oznaczenia IP, dwadzieścia dwa (22) są w trakcie rozpatrywania, a siedem (07) wniosków zostało odrzuconych.
Właściwy czas na wejście do ILAP jest wymieniony poniżej.
- Na wczesnym lub średnim etapie rozwoju produktu
- Gdy dostępne są odpowiednie dane
- Gdy wnioskodawcy czują potrzebę uzyskania informacji od interesariuszy
- Wnioskodawcy dążą do przyjęcia nowych, innowacyjnych podejść
- Nie, gdy produkt znajduje się pod koniec etapu rozwoju.
Przegląd rozwoju medycyny
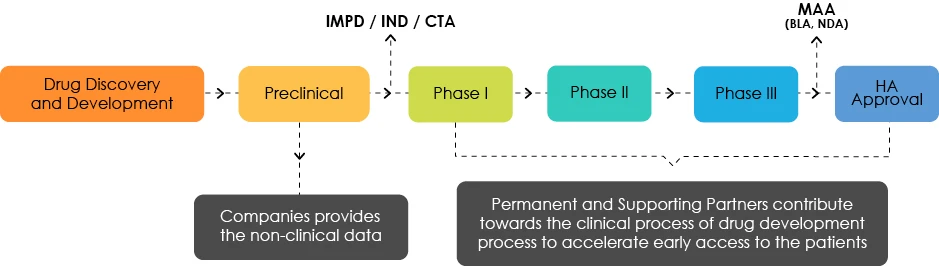
Zrozumienie docelowego profilu rozwoju (TDP)
Eksperci TDP analizują charakterystykę produktu i podkreślają niedociągnięcia z regulacyjnego punktu widzenia. Są oni odpowiedzialni za wskazanie twórcom leków planu działania, który zapewni wczesny dostęp pacjentów do ich produktów.
TDP to dokument, który jest aktualizowany w czasie rzeczywistym zgodnie z wymaganiami dostosowanymi do rozwoju produktu. W związku z tym produkt podlega wielokrotnym zmianom TDP w miarę generowania nowych danych.
Dostępność pacjentów do niezbędnych leków może być ograniczona przez opóźnienia rynkowe. Aby uniknąć takich sytuacji, przyspieszone ścieżki zatwierdzania pełnią rolę katalizatora. ILAP jest przykładem elastycznej ścieżki autoryzacji, która jest dobrze przyjęta w całej branży i może przyspieszyć harmonogram opracowywania innowacyjnych leków. Szczegółowe kryteria określone przez brytyjski system opieki zdrowotnej pozwalają wnioskodawcom sprawdzić, czy kwalifikują się do ubiegania się o oznaczenie IP. Zachęcanie do zaspokajania niezaspokojonych potrzeb klinicznych i pacjentów za pomocą przyspieszonych ścieżek, takich jak ILAP, ułatwia wejście na rynek i może przynieść ulgę populacjom pacjentów zagrożonych. Aby chronić interesy pacjentów, organy ds. zdrowia nie idą na kompromisy w zakresie bezpieczeństwa, skuteczności lub jakości produktu, zapewniając jednocześnie przyspieszony proces zatwierdzania. end-to-end usługi regulacyjne firmy Freyr ułatwiają proces dokumentacji w celu uzyskania oznaczenia „paszportu innowacyjności” w przyspieszonym terminie, pomagając w szybszym reach produktów reach . Skontaktuj się z firmą Freyr.









