
REALIZACJA TERMINU IDMP DO LIPCA 2016 R.: NIE JEST TO ŁATWE ZADANIE
Istnieje wiele pytań dotyczących IDMP gdzie w organizacji znajdują się dane? Czy konieczne jest oczyszczenie i ujednolicenie aktualnych danych? W jaki sposób firmy organizują te dane, aby ułatwić ich wyszukiwanie i przesyłanie? Czy organizacja posiada procesy, które mogą skorzystać z centralnego repozytorium?
Osiągnięcie zgodności z wymogami identyfikacji Produkty lecznicze IDMP) nie jest łatwym zadaniem, ponieważ należy uwzględnić różne ograniczenia regulacyjne i operacyjne. Organizacje muszą poczekać, aż organy wydadzą ostateczne wytyczne i zatwierdzą specyfikacje. Jednocześnie oczekiwanie na te wytyczne może nie pozostawić im wystarczająco dużo czasu na uporządkowanie spraw.
IDMP złożony standard o daleko idących konsekwencjach dla danych, wymagający współpracy i co wielu jednostek międzyfunkcyjnych. Przejście na ten standard stanowi okazję do end-to-end na procesy biznesowe organizacji i możliwości informatyczne wielu jednostek funkcjonalnych. Pomaga również w ustanowieniu solidnego systemu zarządzania zmianami.
Organizacje muszą zrozumieć, że stworzenie dobrej architektury informacji wymaga wysiłku i czasu, a także muszą zdawać sobie sprawę, że IDMP nie IDMP po prostu większym XEVMPD. Należy również pamiętać, że ICH stanowią tylko część całości, a dostępność wytycznych regionalnych ma kluczowe znaczenie. Należy również wziąć pod uwagę, że równoległe wdrożenia regionalne będą miały różny zakres i różne ramy czasowe, a liczba podmiotów dostarczających dane będzie bardzo zróżnicowana.
Ponadto firmy farmaceutyczne zamierzające wprowadzać produkty na rynek w regionach objętych regulacjami muszą zapewnić IDMP od 2016 r. Niedawno EMA dzień IDMP i podzieliła się informacjami na temat stanu IDMP wdrażania IDMP oraz harmonogramu działań. Po rozmowach z branżą farmaceutyczną, dostawcami oprogramowania i analizie własnego systemu oraz dostępności zasobów, EMA podzielić ogólneIDMP na kilka etapów. Plan ten zostanie przedstawiony European Commission KE) do zatwierdzenia, a jeśli uda się przekonać KE, IDMP w UE zostanie rozłożone na lata 2016–2018. W najgorszym przypadku, jeśli KE nie wyrazi zgody, nie ma planu B. Kary za nieprzestrzeganie przepisów wynoszą do 5% przychodów organizacji; brak dobrego rozwiązania zapewniającego początkową i bieżącą IDMP stanowi ryzyko, którego żadna firma farmaceutyczna nie może sobie pozwolić.
IDMP: OPRAcOWANY JAKO GLOBALNY ZESTAW NORM W RAMACH ISO
W przypadku wprowadzenia przepisów dotyczących identyfikacji Produkty lecznicze dowolnym kraju należącym do ISO, zostaną one opracowane w oparciu o IDMP ISO IDMP . Po przyjęciu IDMP przez różne regiony wprowadzanie danych będzie spójne, a globalne przedsiębiorstwa i organy regulacyjne będą miały dostęp do danych umożliwiających sprawdzenie spójności między regionami. Ponadto wspólne kontrolowane słowniki znacznie ułatwią ten proces.
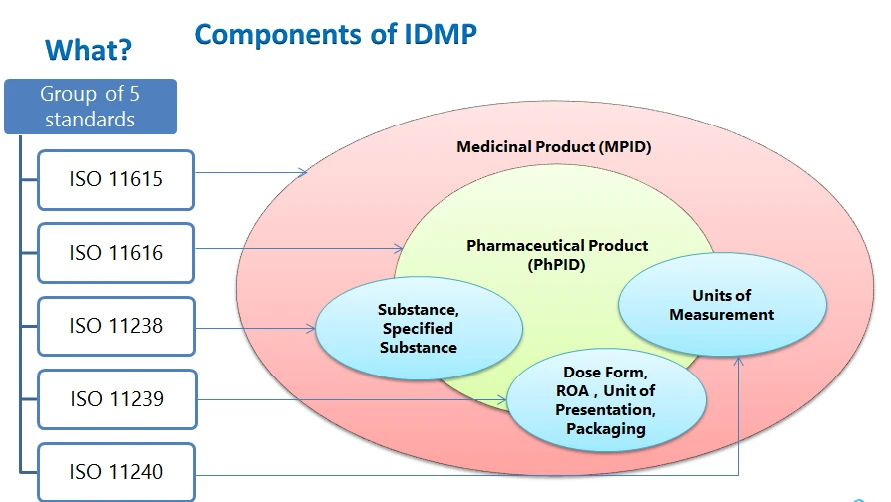
Elementy strukturalne IDMP identyfikator produktu leczniczego, identyfikator produktu farmaceutycznego, identyfikator substancji, kontrolowane słowniki – postać dawkowania, droga podania, składniki opakowania, jednostki prezentacji, jednostki miary oraz opis procesu produkcji, które należy przedłożyć.
IDMP
- ISO 11615 - Informacje o produktach leczniczych
- ISO 11616 - Informacje o produktach farmaceutycznych
- ISO 11238 - Substancje
- ISO 11239 - Postacie dawek farmaceutycznych, jednostki prezentacji, drogi podania i opakowania
- ISO 11240 - Jednostki miary
BIEŻĄCY STATUS
ICH wytyczne dotyczące wdrażania i dokonuje przeglądu norm ISO.
ORGANY REGULACYJNE UE PRZYGOTOWUJĄ SIĘ DO WDROŻENIA IDMP
- EMA współpracę z siecią organów regulacyjnych UE w celu określenia uzasadnienia biznesowego dla IDMP
- EMA „Grupa IDMP UE ds. ISO IDMP w tym celu zatrudni ekspertów z EMA i z Rady ds. Danych Sieci UE. W szczególności będzie:
- Zdefiniuj obowiązkowe i opcjonalne elementy IDMP ISO IDMP .
- Definiowanie reguł biznesowych dla opcjonalnych elementów danych
- Definiowanie zgodności i typów danych
- Określenie modeli zarządzania UE
STANOWISKO US
- Aktywne przywództwo w IDMP wśród globalnych organów regulacyjnych (dawniej ICH) oraz ISO.
INNE ORGANY REGULACYJNE
- Szwajcaria - zamierza wdrożyć po UE (szybki naśladowca)
- Japonia i Kanada nominowały organy regulacyjne na ekspertów w grupie Substance IG
HARMONOGRAMY
EUROPEJSKIE WYTYCZNE DOTYCZĄCE WDRAŻANIA
- Projekt przewodników wdrożeniowych zostanie zainicjowany, a przewodniki będą dostępne od pierwszego kwartału 2016 r.
INNE
- FDA jeszcze daty, ale zamierza rozwijać SPL w miarę potrzeb.
- Japonia – niepewna sytuacja w zakresie ICH obecnie współpracuje z grupą regulatorów i ISO
- Kanada - Oczekuje się, że zostanie wdrożony, ale nie ma jeszcze żadnych szczegółów.
- Szwajcaria - Brak aktualizacji
ZROZUMIENIE WYMOGÓW IDMP
IDMP informacji o Produkty lecznicze postaci zestawu standardowych identyfikatorów, które opierają się na hierarchii identyfikacyjnej utworzonej podczas tworzenia słownika produktów leczniczych EudraVigilance (EVMPD) lub jego rozszerzonej wersji (xEVMPD). Informacje te będą się pokrywać z informacjami zawartymi w Structured Product Labeling (SPL) w Stanach US innych rejestrach produktów na całym świecie.
Jednak IDMP nowe identyfikatory, nowe kategorie i nowe sposoby wyrażania relacji między elementami w modelu danych. IDMP zostać zintegrowane z DNA organizacji, ponieważ musi ono napędzać tworzenie modeli danych w całym przedsiębiorstwie. Infrastruktura IT organizacji może wtedy rozpoznawać je w wielu systemach, procesach biznesowych i jednostkach funkcjonalnych, takich jak RA, bezpieczeństwo, badania i rozwój, dokumentacja i procesy produkcyjne.
WYZWANIA ZWIĄZANE Z IDMP
Organizacyjne
- Dane dystrybuowane między wieloma działami
- Aby zachęcić do udziału, wymagany jest sponsoring seniorów
Techniczne
- Odkrywanie, gromadzenie i konsolidacja czystych danych
- Od 250 do 300 pól na produkt
Co
- Zarządzanie ciągłymi zmianami
- Co między wieloma zespołami
- Utrzymywanie regulacji dotyczących danych w ramach procesów wewnętrznych
WNIOSKI:
IDMP: WPŁYW NA PRZEMYSŁ FARMACEUTYCZNY
Wdrożenie IDMP powinno wpłynąć na przygotowywanie i planowanie wniosków oraz utrzymywanie danych dotyczących całej firmy, w tym danych dotyczących produkcji i ustrukturyzowanych informacji o substancjach, aż po informacje rejestracyjne.
IDMP : WYŻSZA WYDAJNOŚĆ PO WDROŻENIU
Aby Twoja firma była gotowa na IDMP związane IDMP , trzeba będzie ściśle współpracować z wieloma działami w organizacji. Kompetentny dostawca usług z wyjątkowym portfolio kompetencji regulacyjnych może pomóc w dostosowaniu IDMP , co pozwoli firmie reagować na nowe możliwości pojawiające się na rynku.









