
Zapotrzebowanie na leki ratujące życie stale rośnie. Ze względu na pojawienie się nowych chorób o śmiertelnym przebiegu producenci leków poświęcają dużo czasu i pieniędzy na badania i rozwój leków chemicznych i biologicznych. Tak samo jak wynalezienie nowych leków, ich rejestracja może stanowić dla producentów nie lada wyzwanie. Od przygotowania i złożenia wniosku o dopuszczenie nowego leku do badań klinicznych (IND) po wnioski o przeprowadzenie badań klinicznych (CTA) i pozwolenia na dopuszczenie do obrotu (MA) – istnieje szereg procedur regulacyjnych, które należy przestrzegać zgodnie z wytycznymi odpowiednich organów ds. zdrowia (HA).
Producenci muszą zrobić to dobrze za pierwszym razem, aby leki innowacyjne reach rynek bez opóźnień. Pomoże to zaspokoić popyt na leki ratujące życie na określonych rynkach i zapewni producentom zwrot z inwestycji (ROI).
Potrzeba ulepszonych rozwiązań regulacyjnych i zgodnych procesów jest zatem dość istotna. Istnieje kilka powodów, dla których producenci nie są w stanie podążać właściwą ścieżką.
Wyzwania regulacyjne stojące przed producentami leków innowacyjnych
- Brak zrozumienia zawiłości regulacyjnych
- Ograniczona wiedza na temat różnych etapów składania wniosków do władz lokalnych
- Terminy składania dokumentacji medycznej, wspólnego dokumentu technicznego (CTD), raportów z badań klinicznych (CSR) itp.
- Różnice w przepisach, gdy leki mają być sprzedawane na całym świecie
- Brak gotowości do radzenia sobie z wszelkimi problemami lub trudnościami pojawiającymi się na etapie produkcji.
Zalety współpracy z właściwym dostawcą usług/rozwiązań regulacyjnych:
Właściwy partner zapewni, że wszystkie etapy produkcji leków są zgodne z odpowiednimi organami regulacyjnymi i prowadzą do terminowego składania wniosków.
Istnieją cztery (04) etapy produkcji leku innowacyjnego. Są one następujące:
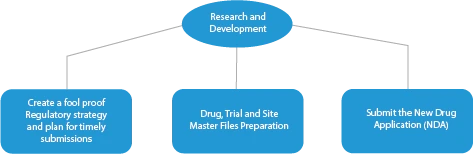
- Badania i rozwój
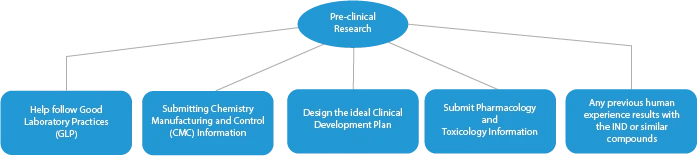
- Badania przedkliniczne/próby
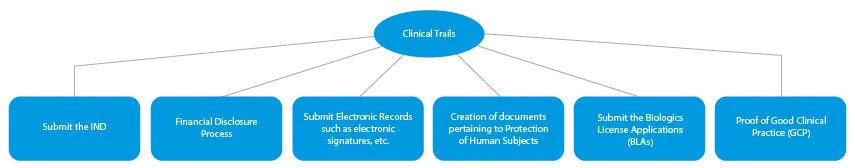
- Badania kliniczne
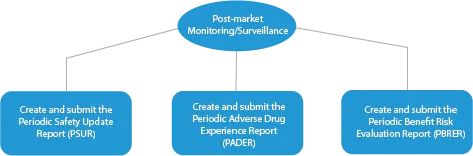
- Monitorowanie/nadzór po wprowadzeniu do obrotu
Każdy etap opracowywania leku wymaga szeregu dokumentów, które należy przedłożyć organom nadzoru. Poniżej przedstawiono, w jaki sposób uznany dostawca usług regulacyjnych pomoże we wszystkich fazach.
Słowo końcowe
Wraz ze wzrostem średniej długości życia ludności na całym świecie pojawia się potrzeba odkrywania nowych leków. Innowacje w dziedzinie nauk przyrodniczych doprowadziły do powstania kilku wynalazków w zakresie leków ratujących życie. Wiele z nich znajduje się na różnych etapach produkcji. Niezależnie od etapu, na którym znajduje się Twój produkt, współpraca z globalnym dostawcą usług regulacyjnych, takim jak Freyr, który posiada doświadczenie w rejestrowaniu leków innowacyjnych, może pomóc Ci uniknąć niezgodności z przepisami i zapewnić, że nowe leki reach na czas. Bądź na bieżąco. Zachowaj zgodność z przepisami.









