
W wysoce regulowanym krajobrazie branży Life Sciences przestrzeganie wytycznych dotyczących konkretnych produktów (PSG) ma kluczowe znaczenie dla pomyślnego opracowania i zatwierdzenia leku. PSG to kompleksowe dokumenty wydawane przez globalne organy ds. zdrowia w celu zapewnienia wytycznych dotyczących zatwierdzania produktów farmaceutycznych w określonych kategoriach terapeutycznych.
Niniejszy blog zawiera szczegółowe informacje na temat celu, znaczenia i perspektywy wydawania PSG przez HA. Zrozumienie uzasadnienia i oczekiwań określonych w PSG, które umożliwiają strategiczny sukces firm z branży nauk przyrodniczych, jest szczegółowo opisane w tym artefakcie.
Zrozumienie wytycznych dotyczących produktów i ich typów
PSG odgrywają kluczową rolę w kształtowaniu ścieżki regulacyjnej dla produktów farmaceutycznych. Zapewniając ukierunkowane wytyczne, organy nadzoru zapewniają spójność i rzetelną ocenę wniosków produktowych w ramach określonych kategorii terapeutycznych. Przestrzegając PSG, firmy farmaceutyczne mogą poruszać się po zawiłym krajobrazie regulacyjnym, zapewniając, że ich produkty spełniają wymagane standardy bezpieczeństwa i skuteczności.
PSG nie ograniczają się do opracowywania leków generycznych. Obejmują one również szeroką gamę produktów farmaceutycznych, takich jak następujące:
- Dla leków innowacyjnych: PSG zapewniają szczegółowe wytyczne dotyczące badań przedklinicznych, projektowania badań klinicznych, oceny bezpieczeństwa, farmakokinetyki i punktów końcowych skuteczności. Wskazują one firmom rodzaj i ilość danych wymaganych do wykazania bezpieczeństwa i skuteczności ich leków innowacyjnych.
- Dla produktów biopodobnych: PSG określają wymagania dotyczące danych, metod analitycznych i rozważań dotyczących projektowania badań klinicznych dla produktów biopodobnych. Postępując zgodnie z nimi, firmy biopodobne mogą wykazać podobieństwo swoich produktów do referencyjnego leku biologicznego, torując drogę do zatwierdzenia i dostępu do rynku.
- Dla leków biologicznych: Wytyczne te dotyczą krytycznych aspektów, takich jak wytwarzanie, charakterystyka i badania porównawcze, zapewniając, że leki biologiczne spełniają zatwierdzone standardy.
Opracowanie wytycznych i procesów specyficznych dla produktu
Opracowywanie PSG to wspólny wysiłek, w który zaangażowane są jednostki ochrony zdrowia, eksperci naukowi i interesariusze branżowi. Poniżej przedstawiono etapy rozwoju PSG:
Etap 1 - Kompleksowa ocena obszaru terapeutycznego: Organy ds. zdrowia identyfikują luki w istniejących wytycznych i inicjują opracowywanie PSG w celu wyeliminowania tych luk. Eksperci naukowi i interesariusze branżowi są następnie angażowani do wniesienia swojej wiedzy specjalistycznej, zapewniając, że projekt wytycznych jest oparty na dowodach i praktyczny do wdrożenia.
Etap 2 - Konsultacje publiczne: Projekty PSG są teraz dostępne do publicznego przeglądu i opinii. To otwarte i przejrzyste podejście pozwala zainteresowanym stronom, w tym pracownikom służby zdrowia, grupom pacjentów i przedstawicielom przemysłu, wnieść cenny wkład i poprawić ogólną jakość i trafność wytycznych.
Etap 3Etap przeglądu wewnętrznego: Podczas gdy projekt PSG jest przedmiotem konsultacji publicznych, zespół ds. rozwoju PSG w HA przeprowadza rygorystyczny przegląd wewnętrzny, upewniając się, że wytyczne spełniają niezbędne wymogi regulacyjne i są zgodne z szerszymi ramami regulacyjnymi.
Etap 4 - Finalizacja: Po sfinalizowaniu PSG są publikowane i udostępniane branży, zapewniając jasne i praktyczne wytyczne dotyczące opracowywania i składania produktów.
Składniki PSG
Firmy z branży nauk przyrodniczych muszą dobrze rozumieć elementy składowe PSG. Poniższy wykres kołowy ilustruje je szczegółowo:
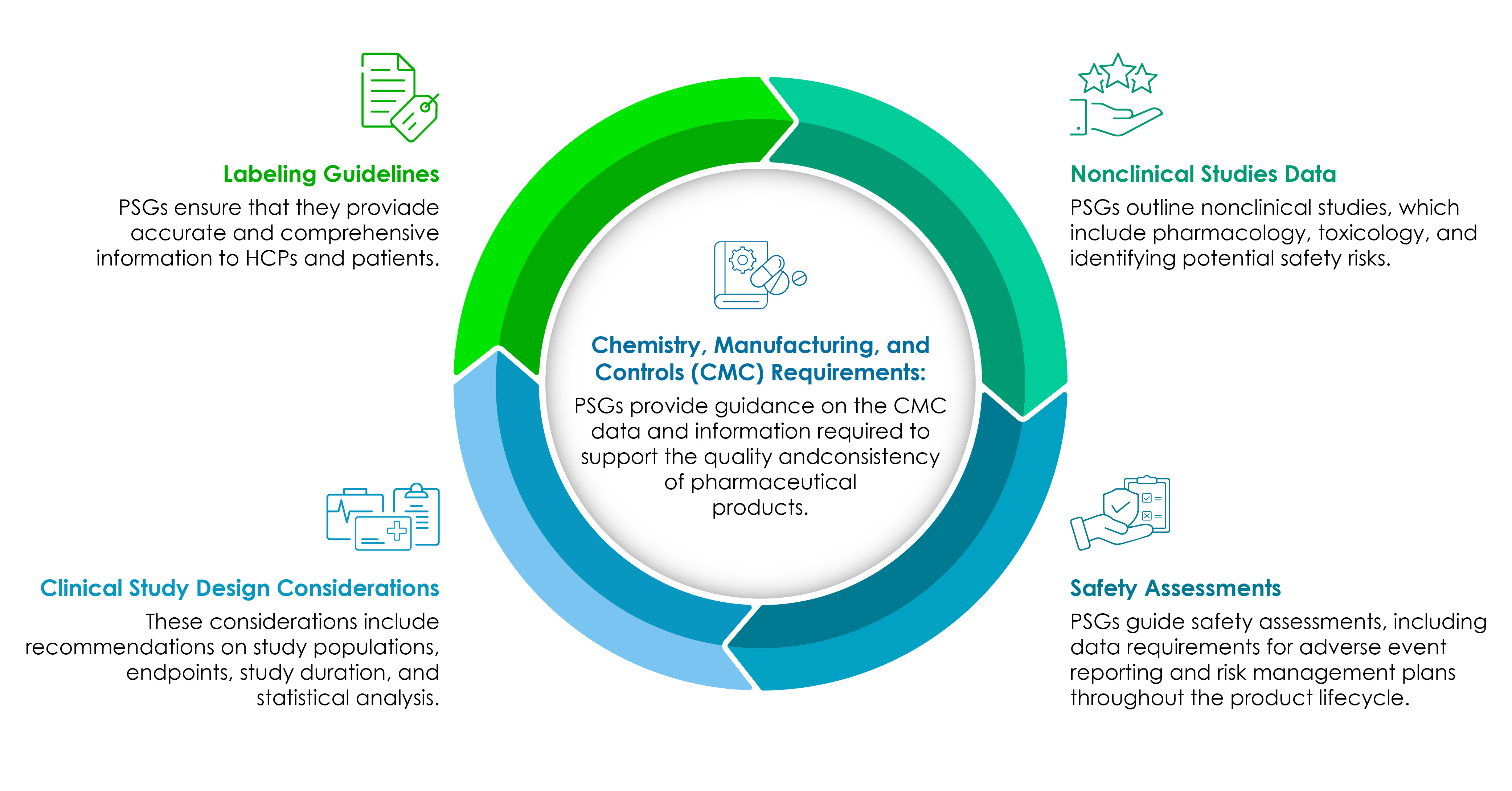
CMC podstawą każdego procesu opracowywania produktów farmaceutycznych pod kątem wymogów regulacyjnych.
Nawigacja po PSG
Poruszanie się po PSG w sposób zgodny z przepisami można osiągnąć dzięki następującym punktom/strategiom:
- Wczesna współpraca z organami służby zdrowia: Takie zaangażowanie sprzyja podejściu opartemu na współpracy i pomaga proaktywnie radzić sobie z potencjalnymi wyzwaniami.
- Wiedza naukowa: Wykorzystanie wkładu ekspertów zapewnia, że projekty badań, metody analityczne i oceny bezpieczeństwa są zgodne z najwyższymi standardami naukowymi.
- Konsultanci ds. regulacji: Konsultanci udzielają fachowych wskazówek, zapewniając powodzenie planów rozwoju i zgłoszeń do organów regulacyjnych.
- Kompleksowy przegląd PSG: Firmy powinny zidentyfikować konkretne sekcje PSG mające zastosowanie do ich produktu i odpowiednio dostosować swoje plany rozwoju.
- Ciągłe monitorowanie: PSG to dynamiczne dokumenty, które mogą być często aktualizowane lub poprawiane. Firmy muszą monitorować zmiany w PSG, aby zapewnić zgodność regulacyjną z najnowszymi wymogami PSG.
Eksperckie wytyczne regulacyjne ułatwiają nawigację po PSG. Skonsultuj się teraz!
Wnioski
Wytyczne specyficzne dla produktu (PSG) stanowią podstawę zgłoszeń do organów regulacyjnych dla produktów farmaceutycznych w określonych kategoriach terapeutycznych. Zrozumienie perspektywy HA stojącej za wydaniem PSG ma kluczowe znaczenie dla firm z branży nauk przyrodniczych, które chcą przyspieszyć zatwierdzanie, zapewnić jakość produktu i płynnie poruszać się po globalnym krajobrazie regulacyjnym.
Jako wiodący dostawca usług regulacyjnych, Freyr ze znaczenia przestrzegania najlepszych praktyk i wykorzystywania wiedzy specjalistycznej, które pomogą firmom z branży nauk przyrodniczych dostosować strategie rozwoju produktów do wymagań PSG. Skontaktuj się us już dziś, aby dowiedzieć się więcej o naszych usługach i tym, jak możemy pomóc Ci osiągnąć Twoje cele.









