
Produkty łączone, które integrują leki, urządzenia i/lub produkty biologiczne, zrewolucjonizowały opiekę zdrowotną, oferując innowacyjne rozwiązania terapeutyczne. Ich unikalny charakter wiąże się jednak z istotnymi wyzwaniami regulacyjnymi. Ten kompleksowy przewodnik bada skomplikowany krajobraz regulacji dotyczących produktów łączonych i zapewnia strategie skutecznego poruszania się po tych złożonych ścieżkach.
Zrozumienie produktów łączonych i ich ram regulacyjnych
Produkty złożone to produkty medyczne, które łączą dwa (2) lub więcej regulowanych składników – leki, urządzenia lub produkty biologiczne – w jedną całość. Te innowacyjne produkty mogą mieć różne formy, takie jak stenty uwalniające leki, ampułkostrzykawki lub plastry transdermalne. Ramy regulacyjne dotyczące produktów złożonych są regulowane przede wszystkim przez Amerykańską Agencję ds. Żywności i Leków (FDA) w Stanach Zjednoczonych, a podobne podejście przyjęły organy regulacyjne na całym świecie.
Biuro ds. Produktów Kombinowanych (OCP) FDA odgrywa kluczową rolę w określaniu podstawowego sposobu działania produktu kombinowanego (PMOA), który decyduje o ścieżce regulacyjnej i głównym FDA odpowiedzialnym za przegląd. Centrum Oceny i Badań Leków (CDER), Centrum Urządzeń i Zdrowia Radiologicznego (CDRH) oraz Centrum Oceny i Badań Produktów Biologicznych (CBER) współpracują w procesie oceny, podkreślając potrzebę zintegrowanego podejścia w celu zapewnienia bezpieczeństwa i skuteczności produktów złożonych.
Określanie ścieżki regulacyjnej
Jednym (1) z najważniejszych etapów opracowywania strategii regulacyjnej dla produktów łączonych jest określenie odpowiedniej ścieżki regulacyjnej. Decyzja ta opiera się przede wszystkim na PMOA produktu. Oto kluczowe kwestie do rozważenia:
- Podstawowy sposób działania (PMOA): Określenie pojedynczego sposobu działania, który zapewnia najważniejsze działanie terapeutyczne produktu skojarzonego.
- Przypisanie ośrodka wiodącego: W oparciu o PMOA produkt zostanie przypisany do CDER, CDRH lub CBER w celu przeprowadzenia przeglądu pierwotnego.
- Rodzaj wniosku regulacyjnego: W zależności od głównego ośrodka wniosek może mieć formę wniosku o rejestrację nowego leku (NDA), wniosku o licencję na produkt biologiczny (BLA) lub wniosku o zatwierdzenie przed wprowadzeniem do obrotu (PMA).
- Wniosek o wyznaczenie (RFD): Jeśli PMOA jest niejasna, sponsorzy mogą przesłać RFD do OCP w celu formalnego ustalenia.
- Wstępny wniosek o wyznaczenie (Pre-RFD): OCP może otrzymać Pre-RFD w celu uzyskania nieformalnej, niewiążącej informacji zwrotnej na temat klasyfikacji i jurysdykcji.
Zrozumienie tych czynników ma kluczowe znaczenie dla opracowania skutecznej strategii regulacyjnej dostosowanej do konkretnego produktu łączonego.
Poruszanie się po procesach przeglądu przed wprowadzeniem na rynek
Proces przeglądu przed wprowadzeniem do obrotu produktów łączonych może być złożony i wymagać starannego planowania i realizacji. Oto kluczowe strategie skutecznego poruszania się po tym procesie:
- Wczesne nawiązanie współpracy z organami regulacyjnymi: Rozpocznij rozmowy z FDA procesu opracowywania produktu poprzez spotkania przed złożeniem wniosku. Takie interakcje mogą dostarczyć cennych wskazówek dotyczących wymagań regulacyjnych, projektów badań i potencjalnych wyzwań.
- Kompleksowy plan rozwoju: Opracuj solidny plan, który uwzględni unikalne aspekty Twojego produktu złożonego, w tym sposób interakcji jego części składowych oraz ich łączny wpływ na bezpieczeństwo i skuteczność.
- Zintegrowane podejście do testowania: Zaprojektowanie badań przedklinicznych i klinicznych oceniających poszczególne składniki i kompletny produkt złożony. Podejście to powinno oceniać potencjalne interakcje i skumulowane efekty.
- Kwestie związane z systemem jakości: Należy wdrożyć system jakości zgodny z przepisami dotyczącymi leków (21 CFR 210/211) i urządzeń (21 CFR 820), odpowiedni dla danego produktu.
- Inżynieria czynników ludzkich: Uwzględnienie badań nad czynnikami ludzkimi w celu oceny interakcji użytkownika z połączonym produktem, zapewniając bezpieczne i skuteczne użytkowanie.
- Zarządzanie ryzykiem: Opracowanie kompleksowego planu zarządzania ryzykiem, który uwzględnia potencjalne zagrożenia związane z każdym komponentem i ich kombinacją.
Przyjmując te strategie, sponsorzy mogą usprawnić proces przeglądu przed wprowadzeniem do obrotu i zwiększyć prawdopodobieństwo sukcesu regulacyjnego.
Rozwiązywanie wyzwań po wprowadzeniu na rynek
Obowiązki regulacyjne dotyczące produktów złożonych wykraczają poza zatwierdzenie do obrotu. Skuteczny nadzór po wprowadzeniu do obrotu i zgodność z przepisami mają kluczowe znaczenie dla długoterminowego sukcesu. Należy rozważyć następujące strategie:
- Zintegrowane monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny: Wdrożenie solidnego monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny rejestruje zdarzenia niepożądane związane ze składnikami leku i urządzenia produktu złożonego.
- Badania po wprowadzeniu do obrotu: Planowanie i przeprowadzanie badań po wprowadzeniu na rynek w celu zebrania dodatkowych danych dotyczących bezpieczeństwa i skuteczności, zwłaszcza w przypadku nowych produktów łączonych.
- Utrzymanie systemu jakości: Ciągłe aktualizowanie i utrzymywanie systemu jakości w celu zapewnienia zgodności z odpowiednimi przepisami dotyczącymi komponentów leków i urządzeń.
- Zarządzanie zmianami: Ustanowienie prostego procesu zarządzania zmianami po zatwierdzeniu, z uwzględnieniem potencjalnego wpływu na aspekty produktu związane z lekami i urządzeniami.
- Analiza przepisów: Bądź na bieżąco ze zmieniającymi się przepisami i wytycznymi dotyczącymi produktów łączonych, aby zapewnić stałą zgodność z przepisami.
Dzięki proaktywnemu podejściu do tych wyzwań po wprowadzeniu produktu na rynek, producenci mogą zachować zgodność z przepisami i bezpieczeństwo produktu przez cały cykl jego życia.
Globalne względy regulacyjne
Wraz z globalnym rozwojem rynku produktów łączonych, zrozumienie międzynarodowych wymogów regulacyjnych staje się coraz ważniejsze. Rozważ poniższe strategie globalnego sukcesu regulacyjnego:
- Harmonizacja przepisów: Wykorzystanie międzynarodowych wysiłków harmonizacyjnych, takich jak te podejmowane przez Międzynarodowe Forum Regulatorów Urządzeń Medycznych (IMDRF), w celu usprawnienia globalnych zgłoszeń regulacyjnych.
- Wymagania specyficzne dla rynku: Zbadanie i zrozumienie specyficznych wymagań dotyczących produktów łączonych na rynkach docelowych, ponieważ przepisy różnią się znacznie w zależności od kraju.
- Jednoczesne składanie wniosków: W stosownych przypadkach należy rozważyć jednoczesne składanie wniosków do wielu agencji regulacyjnych w celu przyspieszenia dostępu do rynku globalnego.
- Globalne badania kliniczne: Projektowanie badań klinicznych spełniających wymagania wielu agencji regulacyjnych w celu wsparcia globalnych wniosków marketingowych.
- Partnerstwa międzynarodowe: Współpraca z lokalnymi ekspertami ds. regulacji lub partnerami na rynkach docelowych w celu poruszania się po przepisach krajowych i uwarunkowaniach kulturowych.
Przyjmując globalną perspektywę w opracowywaniu strategii regulacyjnej, producenci mogą skuteczniej poszerzać reach rynkowy produktów złożonych.
Wnioski
Poruszanie się po ścieżkach regulacyjnych dla produktów łączonych wymaga kompleksowego zrozumienia złożonych ram regulacyjnych i planowania strategicznego.
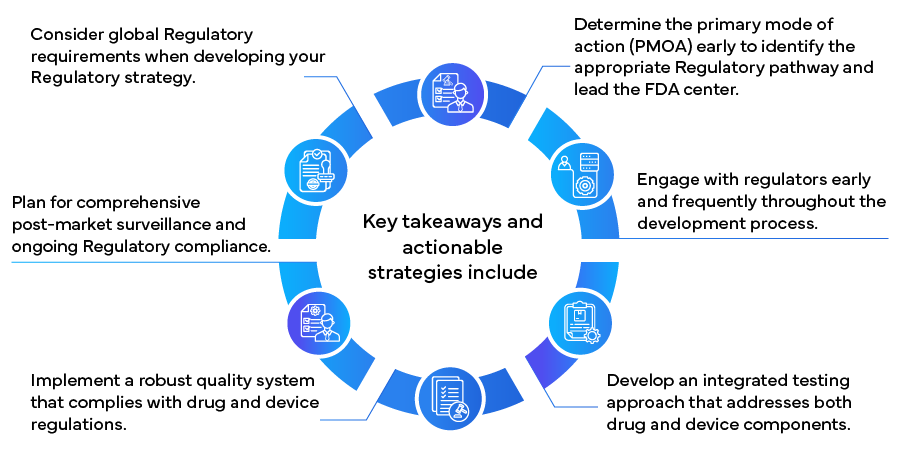
Wdrażając te strategie, producenci mogą skuteczniej poruszać się po złożonym środowisku regulacyjnym dla produktów łączonych, potencjalnie przyspieszając czas wprowadzenia na rynek i zapewniając długoterminową zgodność i sukces. Ponieważ dziedzina produktów łączonych nadal ewoluuje, bycie na bieżąco ze zmianami regulacyjnymi i utrzymywanie elastyczności w podejściach regulacyjnych będzie miało kluczowe znaczenie dla ciągłego sukcesu w tym innowacyjnym i szybko rozwijającym się sektorze opieki zdrowotnej.









