
Zezwolenia na stosowanie w sytuacjach wyjątkowych (EUA) mają duże znaczenie dla szybszego Produkty lecznicze pacjentom Produkty lecznicze ratujących życie. Okazały się one pomocne w walce z pandemiami, takimi jak COVID-19. Inicjatywa amerykańskiej Agencji ds. Żywności i Leków (USFDA) rozpoczęła się w 2004 r., a EUA weszło w życie, gdy sekcja 564 federalnej ustawy o żywności, lekach i kosmetykach została zmieniona przez ustawę Project BioShield Act. Program ten jest krokiem podjętym przez FDA ochrony zdrowia publicznego poprzez zapewnienie bezpieczeństwa, skuteczności i jakości produktów medycznych, przy jednoczesnym reagowaniu na sytuacje medyczne wymagające natychmiastowej pomocy i pojawiające się zagrożenia dla zdrowia publicznego.
us to lepiej w poniższych wierszach.
Dekodowanie EUA
Ścieżka EUA jest środkiem ułatwiającym dostęp do medycznych środków zaradczych w sytuacjach ogłoszenia stanu wyjątkowego. Komisarz FDA w takich sytuacjach zezwolić na poniższe działania:
- Dozwolone stosowanie niezatwierdzonych produktów medycznych.
- Nieautoryzowane użycie zatwierdzonych produktów medycznych.
Produkty objęte EUA obejmują szczepionki, płyny infuzyjne, leki, urządzenia, testy itp. i mogą być stosowane do diagnozowania, leczenia lub zapobiegania stanom zagrażającym życiu. Produkty otrzymują EUA, jeśli spełnione są następujące kryteria:
- Dowód stanu/choroby zagrażającej życiu.
- Dane naukowe dostarczają wystarczających dowodów na to, że produkt jest skuteczny w zamierzonym zastosowaniu.
- Korzyści płynące z produktu przewyższają ryzyko (czyli dowody bezpieczeństwa).
- Brak alternatywnych produktów.
Sponsorom zaleca się zapoznanie się z wymogami FDAz wyprzedzeniem, aby mogli postępować zgodnie z najlepszymi praktykami regulacyjnymi i zapewnić bezbłędne złożenie wniosku o zezwolenie na stosowanie w sytuacjach wyjątkowych (EUA). Poniżej przedstawiono informacje obowiązkowe, które sponsor musi podać we wniosku.
Dane, które sponsor musi przedłożyć FDA zezwolenia na stosowanie w sytuacjach wyjątkowych (EUA)
- Opis produktu i jego przeznaczenie.
- Status zatwierdzenia produktu przez FDA.
- Informacje dotyczące bezpieczeństwa i skuteczności, takie jak dane kliniczne i niekliniczne itp.
- Raport z analizy ryzyka i korzyści.
- Dane dotyczące chemii, produkcji i kontroli (CMC).
- Informacje na temat dawkowania, przeciwwskazań, ostrzeżeń i zdarzeń niepożądanych dotyczących dystrybucji danego produktu medycznego.
W jaki sposób FDA wydaje zezwolenia EUA?
Poniżej znajduje się schematyczna interpretacja cyklu życia EUA w skrócie:
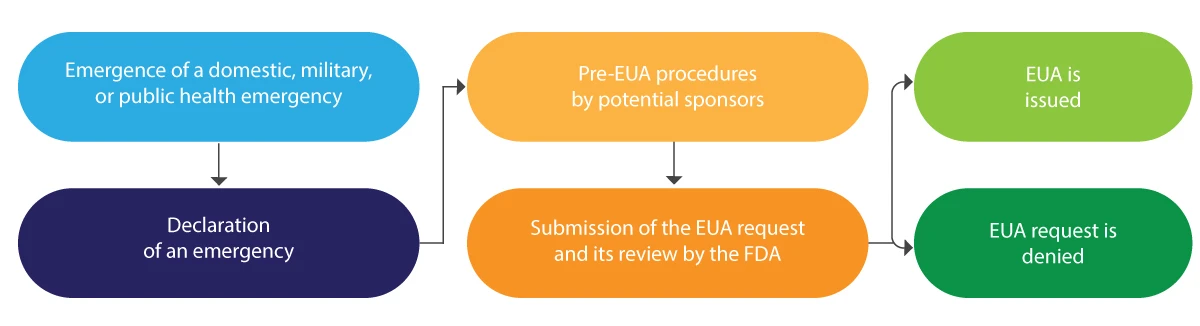
EUA jest zazwyczaj wydawane na czas określony, a po zakończeniu danego stanu wyjątkowego zostaje unieważnione przez FDA.
EUA i COVID-19
Sekretarz ds. Zdrowia i Nauk Humanistycznych (HHS) ogłosił COVID-19 pandemią 31 stycznia 2020 r. Od tego czasu FDA kluczową rolę w zatwierdzeniu kilku szczepionek i domowych zestawów testowych w ramach procedury EUA, aby poradzić sobie z trwającą globalną epidemią.
Wraz z pojawieniem się nowych wariantów COVID-19 cała branża farmaceutyczna intensywnie pracuje nad ograniczeniem rozprzestrzeniania się wirusa i zmniejszeniem śmiertelności. Istnieje potrzeba opracowania nowych Produkty lecznicze przyspieszenia procesu ich zatwierdzania przez globalne organy regulacyjne, aby skrócić czas ich wprowadzenia na rynek. Zdaniem ekspertów, droga do rejestracji nowych Produkty lecznicze poprzez EUA jest właściwym rozwiązaniem. Kilka innych organów ds. zdrowia, takich jak Europejska Agencja Leków (EMA), Central Drugs Standard Control Organization CDSCO), Saudi Food and Drug Authority SFDA) itp., również wdrożyło procedurę EUA w celu przyspieszenia procesu zatwierdzania.
Jeśli jesteś producentem leków i szukasz zezwolenia EUA dla swojego produktu ratującego życie, potrzebujesz doświadczonego dostawcy rozwiązań regulacyjnych. Reach z Freyr przyspieszyć wprowadzenie produktu na rynek i zapewnić zgodność z przepisami.









