
Medsafe, znana również jako Urząd wyroby medyczne Leków i wyroby medyczne Nowej Zelandii, zajmuje się regulacją produktów terapeutycznych w Nowej Zelandii. Agencja jest jednostką organizacyjną Ministerstwa Zdrowia. Działa ona w oparciu o kilka aktów prawnych regulujących produkty terapeutyczne, z których najważniejsze to ustawa o lekach z 1981 r. oraz rozporządzenia dotyczące leków. W ustawie o lekach „cel terapeutyczny” jest opisany jako leczenie, diagnozowanie i zapobieganie chorobom lub modyfikacja aktywności fizjologicznej.
Medsafe jest odpowiedzialny za regulację kilku kategorii produktów, które są produkowane, sprzedawane lub dostarczane w Nowej Zelandii. Poniższy diagram przedstawia ich rodzaje.

Istnieją cztery (04) ważne aspekty ram regulacyjnych Medsafe dotyczące leków i wyroby medyczne. Zostały one opisane poniżej:
Kontrola wejścia na rynek i wyjścia z niego
Na etapie przed wprowadzeniem do obrotu leków i produktów pokrewnych ważne jest, aby ocenić je pod kątem bezpieczeństwa, jakości i skuteczności. Na podstawie tych danych Medsafe wydaje zalecenia dla Ministerstwa, które następnie decyduje o przyszłych działaniach. Lek może zostać udostępniony na rynku Nowej Zelandii dopiero po zatwierdzeniu go przez Ministerstwo.
Następnie, w fazie po wprowadzeniu do obrotu, każde zgłoszenie niepożądanego działania leku (ADR) może prowadzić do wycofania tych produktów z użycia. Regulacje przed i po wprowadzeniu do obrotu mają zastosowanie wyłącznie do leków (nowych i już zatwierdzonych (ze zmianami w aktywnym składniku farmaceutycznym (API)) oraz produktów pokrewnych.
wyroby medyczne nie ma obecnie konieczności przeprowadzania oceny i zatwierdzania przed wprowadzeniem do obrotu. Jednak sponsorzy muszą powiadomić ministerstwo o swoich urządzeniach, aby zostały one wprowadzone do bazy danych prowadzonej przez Medsafe. W fazie po wprowadzeniu do obrotu ministerstwo ma prawo wyrazić zgodę, cofnąć, usunąć lub nałożyć zakazy dotyczące sprzedaży wyroby medyczne.
Jakość
Istnieje kilka sposobów, w jakie Medsafe zapewnia jakość produktów terapeutycznych w Nowej Zelandii. Poniżej przedstawiono najważniejsze z nich:
- Ustanowienie standardów jakości na etapie zatwierdzania leków przed wprowadzeniem do obrotu
- Wdrażanie nowozelandzkich standardów jakości lub standardów Międzynarodowej Organizacji Normalizacyjnej (ISO)
- Utrzymanie systemu audytów i licencji dla sponsorów
- Zapewnienie standardów jakości dzięki nadzorowi i stałemu monitorowaniu
- Egzekwowanie wymogów dobrej praktyki wytwarzania (GMP)
Dostęp
Medsafe stosuje kilka środków regulacyjnych w celu kontrolowania dostępu wyłącznie do leków. System kontroli opiera się na klasyfikacji leków, dzięki czemu niektóre z nich są dostępne wyłącznie za pośrednictwem wykwalifikowanych pracowników służby zdrowia. Klasyfikacja jest przeprowadzana przez Komitet Klasyfikacji Leków, który działa pod nadzorem Ministerstwa.
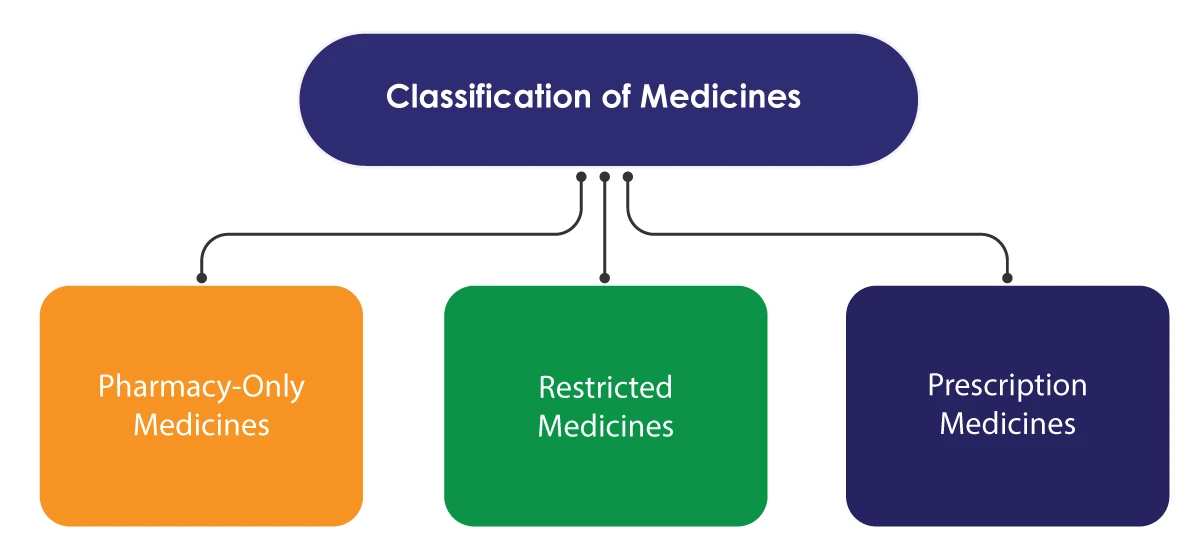
Leki wydawane na receptę są sprzedawane wyłącznie z przepisu lekarza. Leki objęte ograniczeniami mogą być sprzedawane bez recepty, ale muszą być dostarczane przez zarejestrowanego farmaceutę. Sprzedaż musi zostać zarejestrowana w celach informacyjnych. Leki dostępne wyłącznie w aptekach mogą być sprzedawane w społecznościach, aptekach szpitalnych lub innych licencjonowanych sklepach.
Istnieje jeszcze jedna kategoria znana jako Leki powszechnego użytku. Leki, które nie są wymienione w harmonogramach klasyfikacji Medsafe, należą do tej kategorii. Mogą one być sprzedawane w każdym sklepie.
Informacje
Medsafe podejmuje się innej ważnej funkcji regulacyjnej, którą jest dostępność dokładnych informacji o produktach w Nowej Zelandii. Informacje te obejmują, ale nie ograniczają się do etykietowania, danych dotyczących przepisywania i recept na leki objęte ograniczeniami oraz kontroli reklam.
Jako sponsor/producent pragnący rozszerzyć swoją działalność w Nowej Zelandii, będziesz potrzebować wsparcia sprawdzonego eksperta ds. regulacji, takiego jak Freyr. Skontaktuj się us, aby uzyskać kompleksowe usługi i rozwiązania w zakresie regulacji.









