
Firmy farmaceutyczne poszukujące nowych perspektyw biznesowych uważają Koreę Południową za atrakcyjny rynek z szybko rozwijającym się przemysłem farmaceutycznym. Z ponad dziewięciuset (900) nowymi lekami w przygotowaniu i eksportem o łącznej wartości 3,1 mld USD, Korea Południowa zapewnia ogromny potencjał dla produkcji dużych farmaceutyków.
W Korei Południowej złożenie wniosku o rejestrację nowego leku (NDA) lub wniosku o licencję na produkt biologiczny (BLA) jest kluczowym krokiem w wprowadzaniu nowych produktów farmaceutycznych na rynek. Ministerstwo Bezpieczeństwa Żywności i Leków (MFDS) jest odpowiedzialne za rozpatrywanie i wydawanie zezwoleń na NDA i BLA w Korei Południowej. Procedura rozpatrywania wniosku może trwać do stu osiemdziesięciu (180) dni, ale jeśli lek zostanie zakwalifikowany do priorytetowego rozpatrzenia lub procedury przyspieszonej, czas ten może ulec skróceniu.
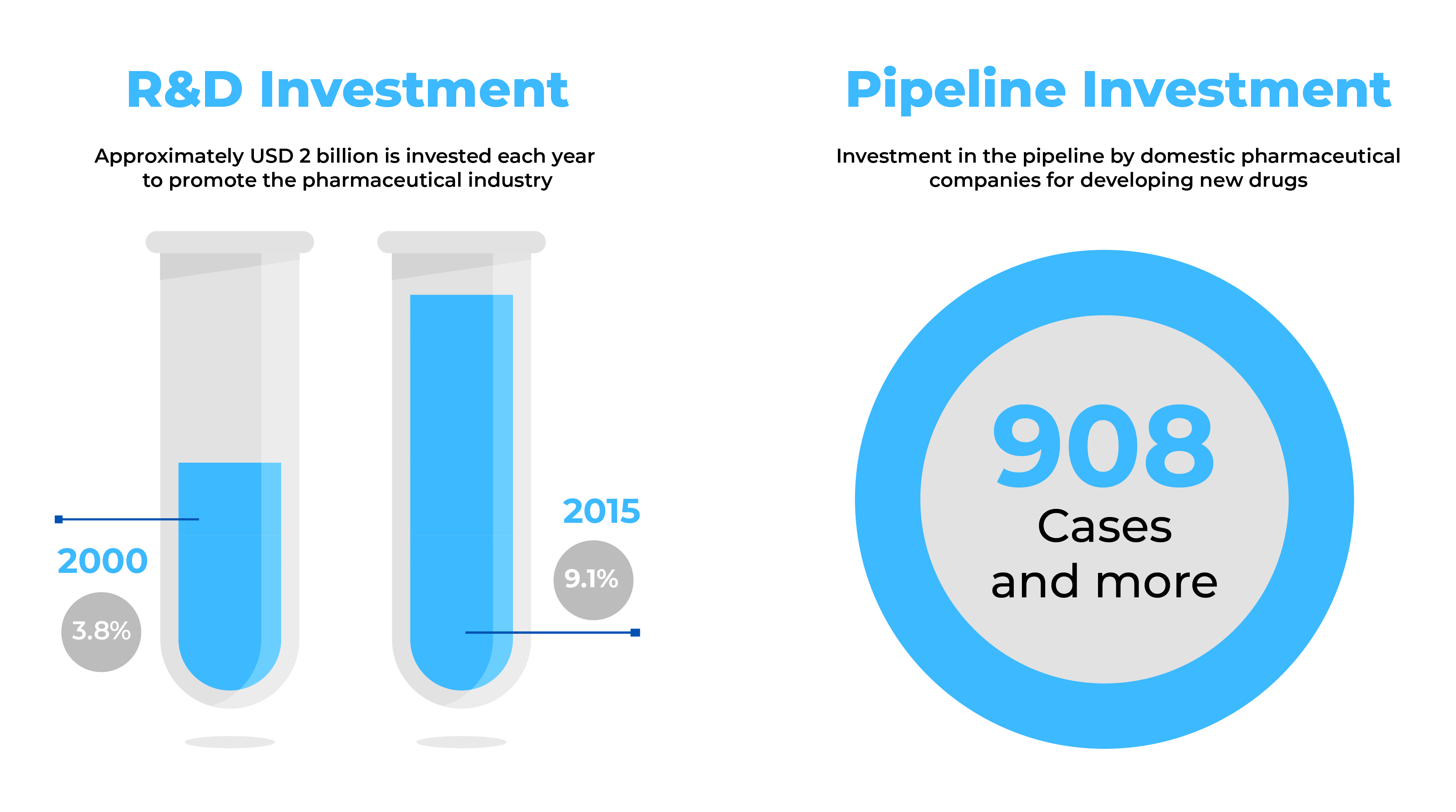
Źródło: Trendy w branży ochrony zdrowia - wrzesień 2014 r. i dane globalne (2017 r.)
BLA w Korei Południowej oferują takie korzyści, jak szybszy proces zatwierdzania, jasne przepisy i wymagania, uwzględnienie danych rzeczywistych (RWE) oraz zwolnienia dla leków sierocych. JednakBLA w Korei Południowej może być złożony i czasochłonny. Proces składania wniosku o rejestrację nowego leku (NDA) lub wniosku o licencję na produkt biologiczny (BLA) w Korei Południowej obejmuje kilka etapów.
Poniżej znajduje się przegląd procesu:
- Badania przedkliniczne: Zanim lek może zostać oceniony na ludziach, musi najpierw zostać przetestowany na zwierzętach, aby zapewnić jego bezpieczeństwo i skuteczność. Zazwyczaj testy te przeprowadzane są na zwierzętach.
- Badania kliniczne: Po zakończeniu badań przedklinicznych lek przechodzi do badań klinicznych na ludziach. Badania te są podzielone na trzy (03) fazy, z których każda obejmuje większą liczbę uczestników.
- BLA : Po zakończeniu badań klinicznych sponsor może złożyć wniosek NDA BLA Ministerstwa Bezpieczeństwa Żywności i Leków (MFDS) Republiki Korei. Wniosek musi zawierać wszystkie pięć (05) modułów elektronicznego wspólnego dokumentu technicznego (eCTD), które obejmują dane niekliniczne, kliniczne oraz dane dotyczące chemii, produkcji i kontroli (CMC).
- Zatwierdzenie: Jeśli MFDS uzna, że lek jest bezpieczny i skuteczny, wniosekBLA zatwierdzony. Po zatwierdzeniu lek może być reklamowany i sprzedawany w Korei Południowej.
Nadal nie odpowiada na wszystkie pytania?
Niech eksperci to wyjaśnią.
Aby uzyskać szczegółowe informacje na tematBLA w Korei Południowej, Freyr bezpłatne webinarium z udziałem naszych ekspertów z Korei Południowej. us webinarium „PrzeglądBLA w Korei Południowej”, które odbędzie się 29 listopada 2023 r. o godz. 11:30 czasu indyjskiego (ROW) oraz o godz. 10:00 czasu wschodnioamerykańskiego | 15:00 czasu GMT | 16:00 czasu środkowoeuropejskiego (Ameryka i EUA). Zarejestruj się już teraz! Bądź bezpieczny. Bądź na bieżąco.
Dla AMR i regionów UE
10:00 EST | 3:00 GMT | 4:00 CET
Dla RoW
11:30 IST









