
Po prawie dwóch (02) dekadach od wydania pierwszego projektu wytycznych, Amerykańska Agencja ds. Żywności i Leków (US FDA) sfinalizowała wytyczne dotyczące farmakokinetyki populacyjnej (PK) w lutym 2022 r. Najnowszy projekt wyjaśnia zastosowanie farmakokinetyki populacyjnej w opracowywaniu leków oraz zawiera zalecenia dotyczące indywidualizacji terapii. Wytyczne mają zastosowanie do wniosków o dopuszczenie nowych leków do badań klinicznych (IND), wniosków o dopuszczenie nowych leków do obrotu (NDA), wniosków o licencję na produkty biologiczne (BLA) oraz skróconych wniosków o dopuszczenie nowych leków do obrotu (ANDA).
Dane z analizy PK populacji muszą być uwzględnione przez sponsorów/producentów leków we wnioskach marketingowych w celu uproszczenia działań po wprowadzeniu leku na rynek. Mogą one również mieć kluczowe znaczenie w udzielaniu odpowiedzi na pytania organów regulacyjnych.
Zrozumienie PK populacji
Badanie zmienności stężeń leków w populacji pacjentów otrzymujących klinicznie istotne dawki określonego leku definiuje się jako populacyjną PK. Jego celem jest identyfikacja i ilościowe określenie źródeł zmienności, które są przydatne w produkcji i zalecaniu dawek wspomnianych leków.
Aby zrozumieć cały proces PK populacji, można odwołać się do poniższej ilustracji:
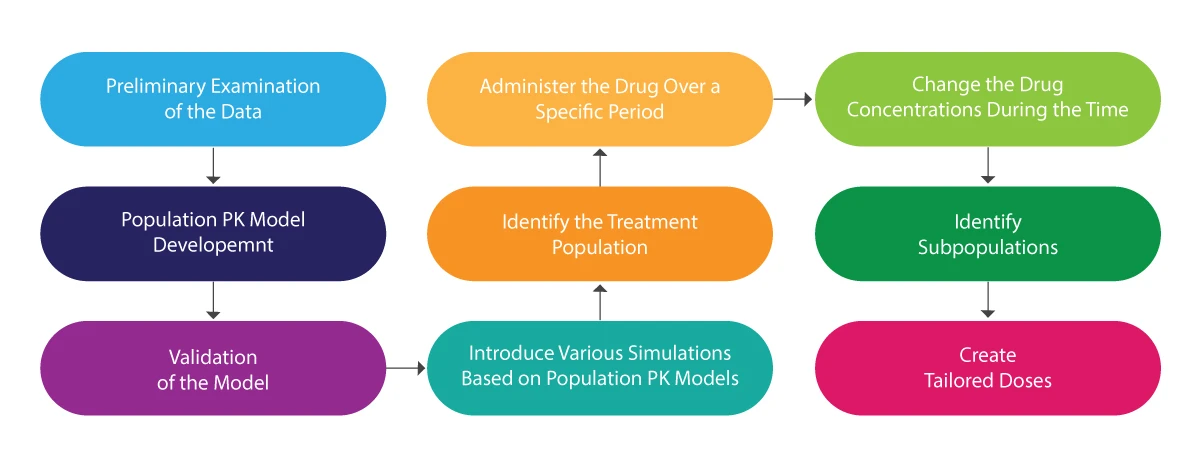
Analiza PK populacji - w czym pomaga?
- Pomaga w projektowaniu niestandardowych schematów dawkowania.
- Zapewnia wiarygodne oszacowanie kowariancji (zmiennej, której zmianę można przewidzieć w badaniu i którą można wykorzystać do przewidzenia wyniku wspomnianego badania).
- Uwzględnia czynniki takie jak demografia, czynniki środowiskowe, biologiczne, leki towarzyszące (inne leki przyjmowane przez pacjentów podczas badania) oraz stężenie leku.
- Przydatne w projektowaniu bezpieczniejszych i jakościowych badań klinicznych, w tym pediatrycznych.
- Uzyskanie macierzy narażenia w celu przeprowadzenia analizy narażenie-odpowiedź.
Przegląd ostatecznych wytycznych US FDAdotyczących farmakokinetyki populacyjnej
Ostateczna wersja projektu daje wgląd w aktualne stanowisko FDAdotyczące danych z analizy farmakokinetycznej populacji i przedłożonych modeli, które pomagają w podejmowaniu decyzji regulacyjnych. Oto krótki przegląd projektu:
Etykietowanie - zawiera zalecenia dotyczące uwzględniania trafnych informacji ze wspomnianej analizy w etykietowaniu. Wyniki należy przedstawić w sekcji "Farmakologia kliniczna" i podsumować w innych sekcjach etykiety, zgodnie z wymaganiami.
Treść – Szczegółowo FDA również treść i odpowiedni format, jaki należy stosować przy składaniu raportów dotyczących farmakokinetyki populacyjnej do FDA .
Podejmowanie decyzji regulacyjnych - raporty PK populacji, które są przydatne do podejmowania decyzji regulacyjnych, muszą być zawarte w Module 5 elektronicznego Wspólnego Dokumentu Technicznego (eCTD).
Naprzód
Sponsorzy, którzy potrzebują porad dotyczących wykorzystania analizy populacyjnej PK w procesie opracowywania leków lub w odpowiedzi na pytania organów regulacyjnych, zostali poproszeni o przedstawienie ich podczas ważnych spotkań z Agencją. Ponadto konieczne jest zapewnienie dobrej wydajności modelu w celu uzyskania dokładnych wyników. Można to osiągnąć poprzez wykorzystanie wystarczających danych PK dotyczących konkretnej populacji pacjentów i odpowiednich subpopulacji.
Przedstawicielom producentów leków/sponsorom może sprawiać trudności przedłożenie dokładnych raportów dotyczących farmakokinetyki populacyjnej w formacie eCTD oraz przestrzeganie przepisów dotyczących etykietowania w celu zapewnienia zgodności z przepisami. Reach z ekspertem ds. regulacyjnych, takim jak Freyr, który może pomóc Ci w przedłożeniu dokumentów i działaniach związanych z etykietowaniem regulacyjnym .









