
Los medicamentos de terapia avanzada (ATMP) representan un enfoque vanguardista de la medicina, que aprovecha el poder de las células, los tejidos o los genes para tratar diversas dolencias. Debido a su complejidad y novedad, los requisitos reglamentarios para los medicamentos de terapia avanzada (ATMP) son comprensiblemente estrictos. Esto se extiende al artwork en las solicitudes reglamentarias, que desempeña un papel crucial a la hora de transmitir información crítica de forma clara y concisa.
Al adaptar artwork reglamentario artwork los medicamentos de terapia avanzada (ATMP), deben tenerse en cuenta las siguientes consideraciones:
Consulte a nuestros Artwork normativo
Solicitar una consulta
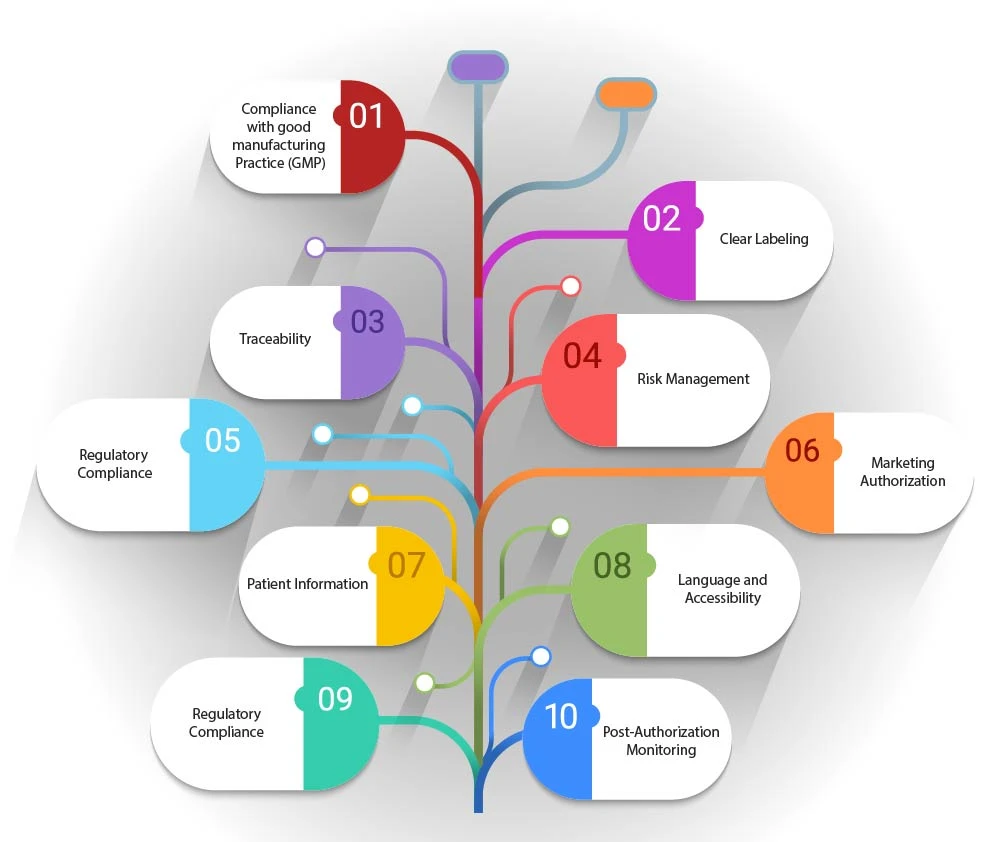
- Cumplimiento de las buenas prácticas de fabricación (BPF): El artwork cumplir con las directrices de BPF específicas para los ATMP, que pueden incluir detalles sobre el proceso de fabricación, el control de calidad y la trazabilidad.
- Etiquetado claro: El artwork indicar la naturaleza del producto, incluyendo si se trata de una terapia génica, una terapia con células somáticas o un producto de ingeniería tisular. También debe incluir cualquier requisito específico de almacenamiento o manipulación.
- Trazabilidad: Dada la naturaleza personalizada de muchos medicamentos de terapia avanzada (ATMP), el artwork facilitar la trazabilidad. Esto puede implicar el uso de identificadores únicos o códigos de barras que permitan el seguimiento del producto desde su fabricación hasta su administración al paciente.
- Gestión de riesgos: Artwork incluir información relacionada con la gestión de riesgos, como posibles efectos secundarios o contraindicaciones, para garantizar que los pacientes y los profesionales sanitarios estén plenamente informados.
- Cumplimiento normativo: El artwork cumplir el marco normativo establecido por la legislación, como el Reglamento (CE) n.º 1394/2007, que establece los requisitos para la autorización de comercialización, la supervisión y la farmacovigilancia de los ATMP.
- Autorización de comercialización: El artwork reflejar el estado de la autorización de comercialización del producto, ya sea que esté totalmente autorizado, en fase de ensayo clínico o sujeto a exención hospitalaria.
- Información para el paciente: Artwork incluir folletos informativos para el paciente que proporcionen información completa sobre el ATMP, su uso y cualquier control que pueda ser necesario después de su administración.
- Idioma y accesibilidad: La artwork diseñarse de manera que sea accesible y comprensible, teniendo en cuenta el idioma y la legibilidad de la información proporcionada.
- Información sobre organismos reguladores: La artwork incluir información sobre los organismos reguladores pertinentes, como la Agencia Europea de Medicamentos (EMA) y el Comité de Terapias Avanzadas (CAT), que se encargan de la evaluación y aprobación de los medicamentos de terapia avanzada (ATMP).
- Seguimiento posterior a la autorización: Si procede, el artwork mencionar cualquier seguimiento posterior a la autorización o estudios adicionales que sean necesarios para evaluar la seguridad y eficacia a largo plazo del ATMP.
La adaptación artwork normativos artwork los ATMP exige un enfoque meticuloso, que equilibre la precisión científica, la claridad en la comunicación y el cumplimiento de los requisitos normativos en constante evolución. Si bien la experiencia interna es valiosa, navegar por este complejo panorama puede resultar inmensamente beneficioso.
Aquí es donde Freyr Solutions en juego la colaboración con un especialista como Freyr Solutions . Freyr cuenta con un equipo de artwork normativo con amplia experiencia en ATMP. Entienden los retos específicos asociados al artwork de ATMP artwork poseen las habilidades técnicas necesarias para crear imágenes claras, conformes y impactantes.
En el competitivo panorama actual, una sólida presentación reglamentaria puede marcar la diferencia entre el éxito y el fracaso. Al asociarse con Freyr Solutions, se asegura de que artwork su ATMP muestre artwork el potencial de su terapia, allanando el camino para un proceso regulatorio más fluido. Con sus conocimientos especializados y su enfoque colaborativo, Freyr se convierte en un activo inestimable para llevar su innovador ATMP al mercado. ¡Póngase en contacto con nosotros hoy mismo!









