
Lorsqu'un établissement étranger se lance dans la production d'un dispositif médical importé aux États-Unis (US), il est obligatoire de désigner un US pour cet établissement. US sert de point de contact pour toute communication US and Drug Administration (US FDA) relative à l'établissement étranger enregistré. Étant donné que ces communications peuvent être urgentes, il est impératif que US ait une compréhension approfondie des FDA et soit capable de conseiller l'établissement étranger sur la conformité aux exigencesFDAen matière de dispositifs médicaux. De plus, le fait d'avoir un US indépendant permet d'éviter les conflits d'intérêts potentiels qui peuvent survenir lorsqu'un partenaire commercial est désigné comme US . Dans cet article, nous allons examiner en détail l'enregistrement d'un établissement étranger auprès US FDA.
Qu'est-ce que l'enregistrement des établissements ?
L'enregistrement annuel auprès de laFDA US FDA obligatoire pour les fabricants sous contrat, les importateurs initiaux, les reconditionneurs/réétiqueteurs, les développeurs de spécifications, etc., des établissements engagés dans la fabrication et la distribution de dispositifs médicaux destinés au marché américain, une procédure appelée « enregistrement d'établissement » (Titre 21 CFR Partie 807).
Who doit demander l'enregistrement d'un établissement ?
Les propriétaires d'installations qui fabriquent et distribuent des dispositifs médicaux destinés à être utilisés aux US procéder à un enregistrement annuel auprès de laFDA US . Les types de propriétaires pouvant demander l'enregistrement de leur établissement sont les suivants :
- Propriétaires d'établissements domestiques
- Propriétaires d'établissements étrangers
- Fabricants sous contrat
- Importateurs initiaux
- Remballeurs/étiquetteurs
- Développeurs de spécifications
Quelles sont les étapes de la procédure d'enregistrement des établissements ?
Pour enregistrer un établissement de dispositifs médicaux auprès de laFDA US , vous devez suivre les étapes décrites dans l'organigramme ci-dessous.
Figure 1 : Étapes de la procédure d'enregistrement d'un établissement
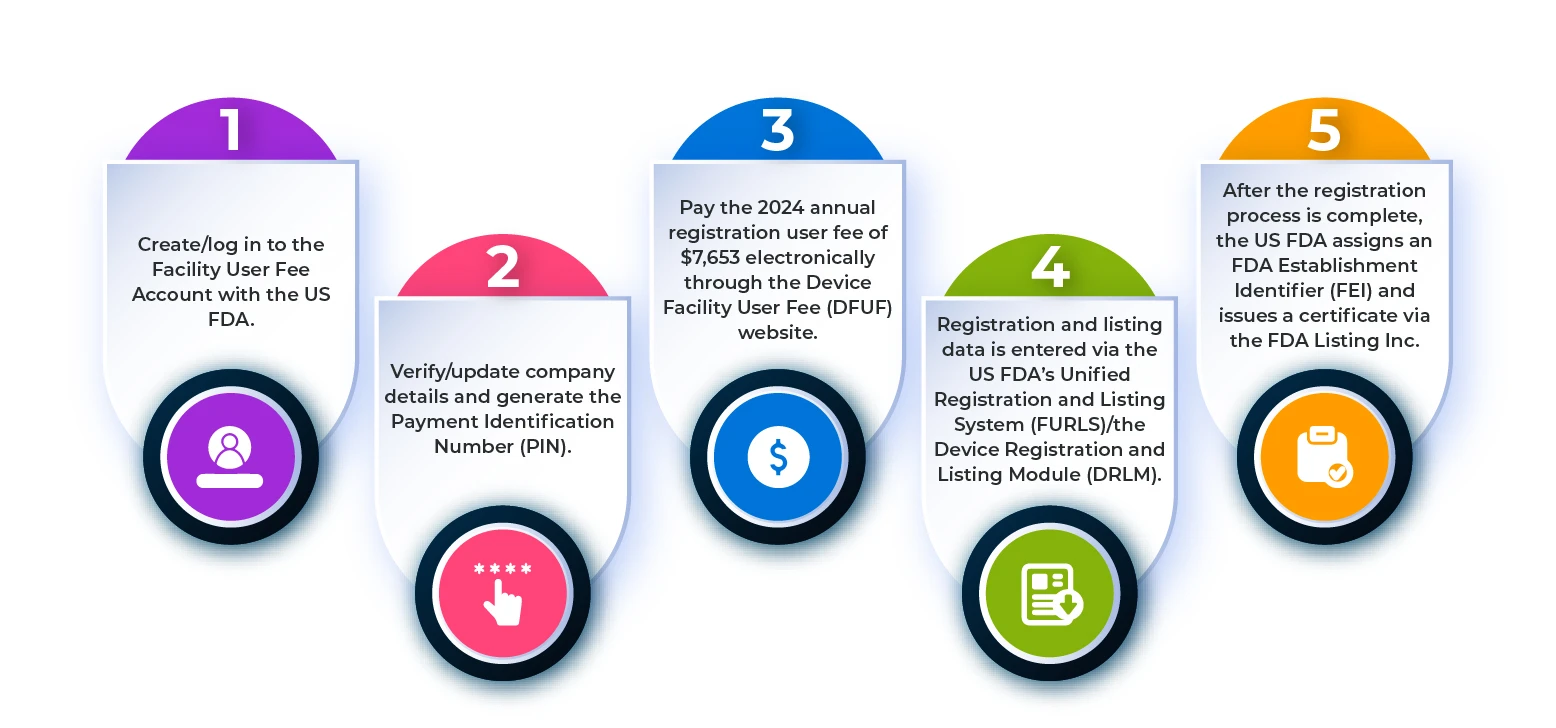
Quelles sont les exigences en matière d'enregistrement et d'inscription des établissements étrangers ?
Comprendre l'importance de choisir un US indépendant et expert aidera un établissement étranger à donner la priorité à la prévention de tout conflit d'intérêts, ce qui est primordial pour les établissements qui naviguent dans le domaine complexe de FDA US . Les établissements étrangers doivent renforcer leur compréhension des conditions préalables à la mise en conformité, favoriser des partenariats solides avec US et préparer le terrain pour un processus d'enregistrement sans heurts. Le tableau ci-dessous présente les exigences en matière d'enregistrement et d'inscription en fonction des activités d'un établissement étranger. Il indique également les activités qui entraînent des frais d'enregistrement pour l'établissement.
Tableau 1 : Exigences en matière d'enregistrement et de cotation en fonction des activités d'un établissement étranger
| Activité | Registre | Liste | Frais d'inscription | |
| Fabricant sous contrat (y compris les conditionneurs sous contrat) | OUI 807.40 (a) | OUI 807.40 (a) | OUI | |
| Stérilisateur à façon | OUI 807.40 (a) | OUI 807.40 (a) | OUI | |
| Fabricants d'appareils sur mesure | OUI 807.20 (a) (2) | OUI 807.20 (a) (2) | OUI | |
| Dispositif faisant l'objet d'une investigation dans le cadre d'une exemption pour dispositif expérimental (IDE) | NO 812.1 (a) | NO 812.1(a),807.40 (c) | NON | |
| Exportateur étranger de dispositifs situés dans un pays étranger | OUI 807.40 (a) | OUI 807.40 (a) | OUI | |
| Fabricants étrangers (y compris les assembleurs de kits) | OUI 807.40 (a) | OUI 807.40 (a) | OUI | |
| Tient à jour les dossiers de plaintes conformément à la 21 CFR 820.198. | OUI | OUI | OUI | |
| Fabricant d'accessoires emballés ou étiquetés en vue d'une distribution commerciale à des fins médicales à un utilisateur final | OUI 807.20 (a) (5) | OUI 807.20 (a) (5) | OUI | |
| Fabricant de composants distribués uniquement à un fabricant d'appareils finis | NO 807.65 (a) | NON | NON | |
| Étiqueteurs ou reconditionneurs | OUI 807.20 (a) (3) | OUI 807.20 (a) (3) | OUI | |
| Remise à neuf | OUI | OUI | OUI | |
| Retraitement de dispositifs à usage unique | OUI 807.20 (a) | OUI 807.20 (a) | OUI | |
| Développeurs de spécifications | OUI | OUI | OUI | |
L'enregistrement auprès de laFDA US FDA une exigence essentielle pour les établissements étrangers impliqués dans la production, la vente, le reconditionnement ou l'importation de dispositifs médicaux aux US. Cet enregistrement garantit la conformité aux réglementations et normes strictesFDA US . Freyr apporte un soutien précieux aux établissements qui recherchent des conseils d'experts pendant le processus d'enregistrement. Grâce à son expertise et à sa connaissance des réglementationsFDA US , Freyr aide les établissements étrangers à se conformer aux exigences réglementaires, ce qui leur permet finalement d'entrer plus facilement et plus efficacement sur le marché US des dispositifs US . Pour en savoir plus sur le processus d'enregistrement auprès de laFDA US , reach dès aujourd'hui. Restez informé ! Restez en conformité !









