Le 24 septembre 2016, à un mois de la date limite de mise en conformité avec l'identifiant unique des dispositifs de classe II (UDI), nous supposons, sans en être certains, que tous les fabricants de dispositifs médicaux sont bien équipés d'une feuille de route réglementaire complète. Outre la maîtrise des prérequis en matière de gouvernance, les fabricants sont censés être prêts pour l'audit de conformité. Qu'il s'agisse de valider les enregistrements des identificateurs de dispositifs (DI) et des identificateurs de produits (PI) ou de réussir les soumissions GUDID, ils doivent connaître les données à soumettre et les procédures à suivre. Que ce soit avant ou après la soumission, une meilleure connaissance des procédures peut protéger les fabricants contre les difficultés liées à l'agrégation des données, à la soumission des enregistrements DI et à la gestion des rapports sur les dispositifs, au suivi des accusés de réception de l'AP, etc.
Pour permettre aux fabricants de mieux se positionner dans de tels scénarios, nous vous proposons ici une infographie sur les défis et les solutions en matière de conformité UDI, qui pourrait vous faire gagner du temps pour décoder les complexités de la conformité et pour mieux planifier et structurer la feuille de route.
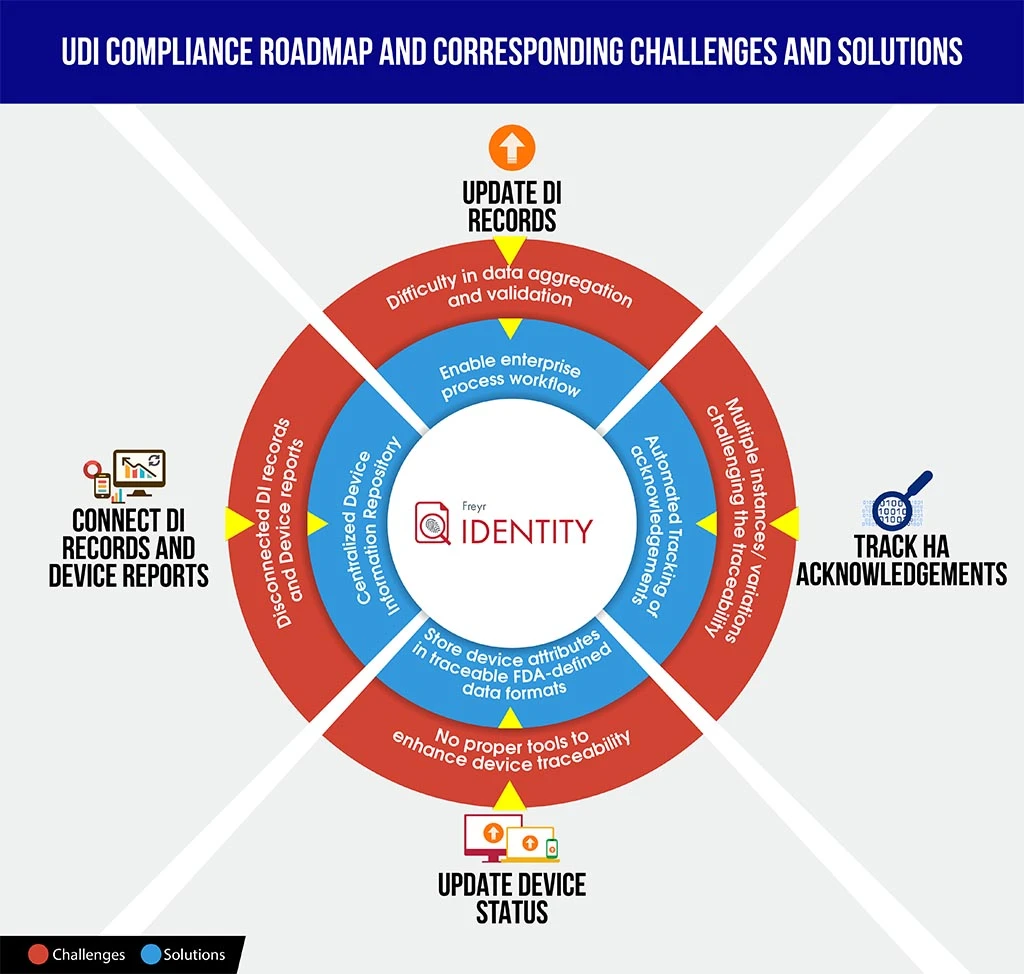
Pour aider votre organisation à naviguer en toute sérénité dans ce processus de conformité complexe, Freyr le meilleur des deux mondes : une solution logicielle UDI à la demande et entièrement configurable,Freyr , ainsi qu'un centre d'excellence UDI (CoE) qui propose des services UDI haut de gamme, rentables et personnalisables, conçus pour répondre à vos exigences spécifiques et complexes.









