Les soumissions sont prévues pour le 24 septembre 2016.
Maintenant que la deuxième phase de mise en conformité UDI, pour les dispositifs médicaux de classe III I/LS/LS, a été mise en œuvre, de nombreux fabricants de dispositifs, en particulier de type classe II, se demandent comment se préparer au mieux pour la date limite de soumission des données relatives aux dispositifs de classe II, fixée au 24 septembre 2016. Afin de les aider, chez Freyr, nous avons identifié certaines des conditions préalables qu'ils doivent prendre en compte pour mettre leurs dispositifs de classe II en conformité avec la réglementation UDI FDA.
La nouvelle réglementation exige que tous les dispositifs médicaux de classe II soient étiquetés et emballés avec un identifiant unique (UDI) et enregistrés dans la base de données mondiale d'identification unique des dispositifs (GUDID) FDA. Compte tenu de la volatilité des exigences de conformité et des délais de soumission plus courts, le défi pour les fabricants de dispositifs consiste à se familiariser avec les détails des processus de conformité. Dans le même temps, ils doivent s'assurer qu'aucun des attributs clés des dispositifs n'est omis lorsqu'ils rassemblent les données dispersées entre différents systèmes et les réconcilient dans des feuilles de calcul afin de créer des rapports de conformité.
Afin d'aider les fabricants d'appareils à naviguer facilement dans ce processus de conformité complexe et urgent, sans commettre d'erreurs, Freyr compilé les conditions préalables suivantes à respecter.
Déterminer la date de conformité à l'UDI: depuis que FDA publié sa règle définitive, certaines dates de conformité des dispositifs ont été modifiées et prolongées. Afin de planifier minutieusement à l'avance les stratégies et les processus de conformité et d'éviter des modifications de dernière minute, les étiqueteurs doivent déterminer la date de conformité exacte.
Date de conformité des dispositifs de classe II Exigences de conformité 24 septembre 2016Les dispositifs de classe III devant être étiquetés avec une UDI doivent porter une UDI en tant que marquage permanent sur le dispositif lui-même s'il s'agit d'un dispositif destiné à être utilisé plus d'une fois et destiné à être retraité avant chaque utilisation. Les étiquettes et les emballages des dispositifs médicaux de classe II doivent porter un UDI Les dates figurant sur les étiquettes de ces dispositifs doivent être formatées comme il se doit. Les logiciels autonomes de classe II doivent fournir leur UDI comme requis. Les données relatives aux dispositifs de classe II qui doivent être étiquetés avec une UDI doivent être soumises à la base de données GUDID. Pour la plupart des dispositifs, la date de conformité pour le marquage direct est différente des autres exigences. En fonction de la catégorie de votre produit, qu'il soit destiné à être réutilisé ou à être retraité, déterminez la date de conformité de l'UDI pour le marquage direct, comme indiqué ici :
Dates de conformité du marquage direct Catégorie de dispositif - Réutilisé et retraité 24 septembre 2015 Dispositifs de maintien en vie et d'aide à la vie, quelle que soit la classe de dispositifs 24 septembre 2016 Dispositifs de classe III et dispositifs autorisés en vertu de la loi sur le service de santé publique (Public Health Service Act) 24 septembre 2018 Dispositifs de classe II 24 septembre 2020 Dispositifs de classe I et dispositifs non classifiés Évaluer la nécessité d'un marquage direct du numéro UDI: Tous les dispositifs médicaux qui sont utilisés plus d'une fois ou qui doivent être retraités avant chaque utilisation doivent comporter un marquage direct du numéro UDI. L'exception concerne les dispositifs implantables qui ne nécessitent pas de marquage direct conformément à la règle de l'UDI. Les dispositifs à usage unique, même s'ils sont retraités, ne sont pas non plus tenus de porter une UDI permanente - 21 CFR 801.45(d)(3). Il convient donc d'évaluer la nécessité d'un marquage direct en fonction de la catégorie de dispositifs médicaux que vous fabriquez.
- Plan de mise en conformité globale: Passez en revue FDA auxquelles vos produits spécifiques doivent se conformer. Effectuez une analyse approfondie des lacunes afin d'identifier les insuffisances en matière de données ou de technologie pour relever certains des principaux défis liés au respect des FDA stricts FDA . Parmi ces défis, on peut citer l'obtention des informations DI ou PI et le traitement de grands volumes de données non structurées provenant de sources disparates, etc. Au lieu de passer des nuits blanches à harmoniser toutes les données relatives aux dispositifs médicaux à la dernière minute, planifiez à l'avance une conformité complète grâce à des systèmes et des outils validés qui prennent en charge l'intégration, la qualité et la gestion des données.
![]()
Obtenir le numéro d'identification (DI) et l'affiliation à l'agence : L'UDI est composé d'un identifiant de dispositif (DI – numéro unique basé sur la version ou le modèle du dispositif) et d'un identifiant de produit (PI – comprend le numéro de lot, le numéro de série ou la date d'expiration). La partie DI de l'UDI servira de clé principale pour rechercher des informations sur le dispositif dans le GUDID. Pour attribuer le DI, la FDA accrédité trois agences émettrices : GS1, HIBCC et ICCBBA. Dans ce scénario, les étiqueteurs doivent adhérer à l'une de ces agences pour obtenir le numéro DI qui doit être saisi dans le GUDID FDA.
![]()
Identifiant Attributs Agences d'émission UDI DI (Device Identifier - Static Data)
Doit être synchronisé avec GUDIDNombre unique de
Fabricant
Marque de l'appareil
Modèle d'appareil
GSI
HIBCC
ICCBBAPI (Product Identifier - Dynamic Data)
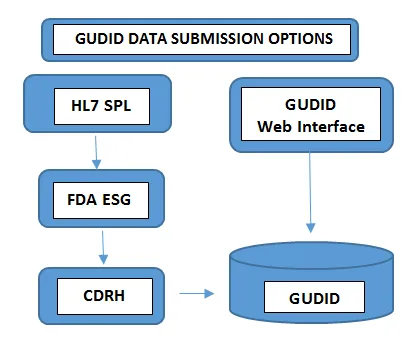
Obligatoire à tous les niveaux de l'emballageNuméro de lot, numéro de série, date de fabrication, date d'expiration, - Soumettre les donnéesLa manière dont vous soumettez les données à la GUDID varie en fonction du volume de votre portefeuille de produits. Les fabricants de dispositifs ayant un nombre minimal de dispositifs choisissent de soumettre les informations UDI manuellement via l'interface Web gratuite FDAGUDID FDA. Dans ce cas, un seul enregistrement DI peut être soumis à la fois via une interface Web sécurisée de la GUDID.Dans l'autre cas, les fabricants disposant d'un plus grand nombre de portefeuilles de produits choisissent l'option de soumission HL7 SPL pour collecter les données par voie électronique et convertir les données consolidées au format SPL avant de les soumettre à la passerelle de soumission électronique (ESG) FDA, en utilisant le numéro DUNS. Veuillez noter que le compte GUDID n'est pas lié au type de soumission. Le compte sert à vous identifier, en tant qu'étiqueteur, afin de permettre la soumission des données relatives aux dispositifs via les deux options.
![]()
- Créer un compte GUDID: un étiqueteur/fabricant d'appareils doit disposer d'un ou plusieurs comptes GUDID en fonction du nombre de rôles à attribuer, notamment coordinateur GUDID, utilisateur chargé de la saisie des données, etc. Cependant, pour autoriser chaque rôle à saisir des données, le fabricant doit obtenir l'accord de la FDA de créer un compte. Le processus de création d'un compte GUDID approprié consiste à envoyer une demande par e-mail à FDA quoi le demandeur, c'est-à-dire vous, recevra un document de demande de compte à remplir. Une fois que vous aurez renvoyé le document rempli à la FDA e-mail, l'agence examinera le formulaire, puis vous enverra un e-mail contenant les informations de connexion à votre compte GUDID.
La mise en œuvre de l'UDI est un processus complexe et chronophage. Au cours de ce processus, tout en se conformant aux exigences FDAl'UDI FDA, les fabricants de dispositifs médicaux sont confrontés à de nombreux défis liés à la gestion, à l'intégration et à la soumission des données. La date limite de mise en conformité pour les dispositifs de classe II étant fixée à seulement un an, Freyr aux entreprises de commencer à s'y préparer dès maintenant.
Pour aider votre organisation à naviguer dans ce processus de conformité complexe, Freyr le meilleur des deux mondes : une solution logicielle UDI à la demande et entièrement configurable,Freyr , ainsi qu'un centre d'excellence (CoE) qui proposedes services UDIde premier ordre, rentables et personnalisables, conçus pour répondre à vos exigences spécifiques et complexes.