
La gestion des risques est une activité essentielle à toutes les phases du cycle de vie des dispositifs médicaux, car elle affecte directement la sécurité et le bien-être des patients. Les risques sont inévitables, mais ils peuvent être réduits si les entreprises sont conscientes des dangers imminents et suivent des procédures efficaces de gestion des risques.
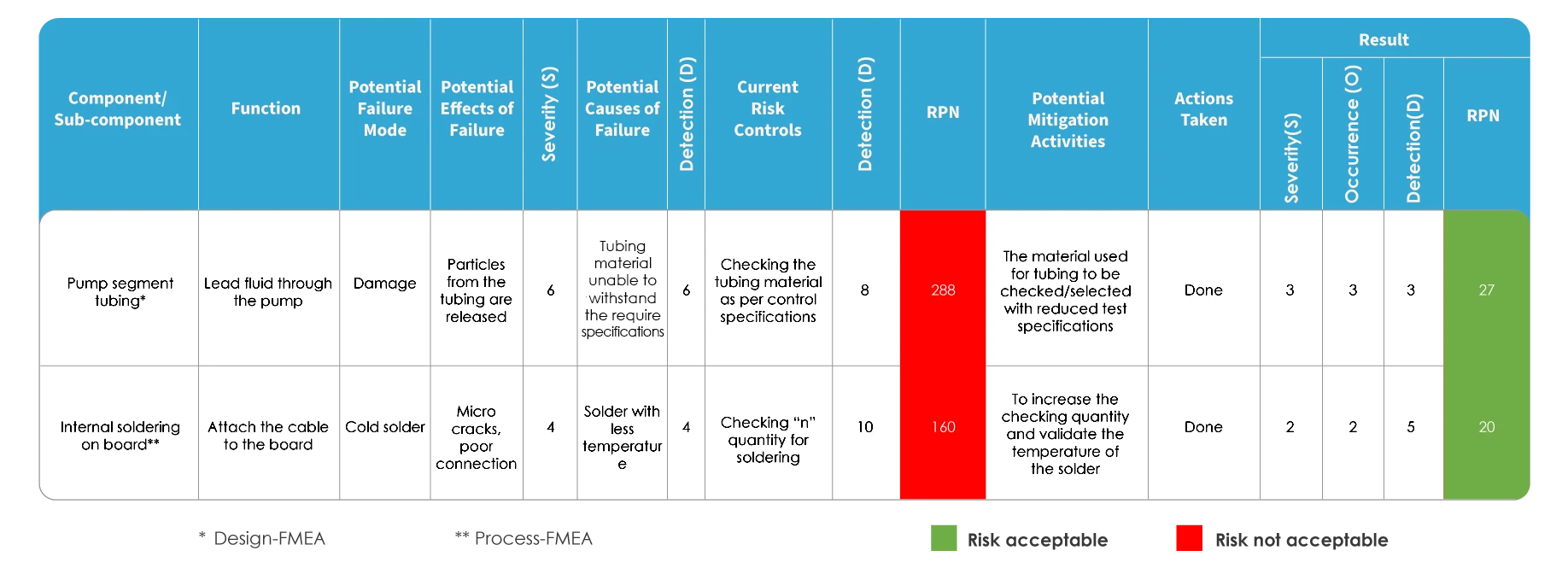
L'analyse des modes de défaillance et de leurs effets (AMDE) est un outil d'examen permettant d'identifier les défaillances possibles d'une conception, d'un processus de fabrication ou d'assemblage, ou d'un produit ou d'un service dans un dispositif. Les "modes de défaillance" désignent les façons dont un dispositif peut tomber en panne, ce qui peut potentiellement affecter les patients. "L'analyse des effets consiste à examiner les conséquences de ces défaillances. Il s'agit d'une approche progressive visant à garantir la fiabilité et la qualité d'un dispositif.
Il existe deux types d'AMDE : L'AMDE de conception (DFMEA) et l'AMDE de processus (PFMEA). Dans le contexte des dispositifs médicaux, les fabricants de dispositifs utilisent l'AMDE pour évaluer les défaillances concernant la conception et les spécifications des dispositifs, tandis que l'AMDE-PF est utilisée pour améliorer le processus de fabrication.
Bien que l'AMDE aborde l'aspect du risque, il ne s'agit pas d'un système de gestion du risque. Les exigences de la gestion des risques sont définies par la norme ISO 14971:2019, qui sert de cadre aux fabricants de dispositifs médicaux pour prévoir la probabilité des risques et leurs conséquences tout au long du cycle de vie du produit. La méthodologie d'évaluation des risques de l'AMDE n'est pas conforme à la norme ISO 14971:2019. L'AMDE a sa propre norme internationalement reconnue, la CEI 60812:2018, qui explique comment l'analyse des modes de défaillance et de leurs effets est planifiée, réalisée, documentée et tenue à jour. L'AMDE et la norme ISO 14971 diffèrent l'une de l'autre sur certains aspects, qui sont les suivants :
Utilisation normale et conditions de défaillance
Selon la norme ISO 14971, la gestion des risques englobe à la fois l'utilisation normale et l'utilisation incorrecte du dispositif, tandis que l'AMDE ne porte que sur les risques associés à la défaillance du dispositif. Un exemple simple est celui des risques associés à la ligne intraveineuse (IV). La norme ISO 14971 prend en compte le risque potentiel d'infection malgré l'administration correcte d'une perfusion intraveineuse. Ce risque peut être dû à diverses raisons, telles qu'une faible immunité du patient et les infections présentes dans l'hôpital/le milieu clinique. Ces risques ne sont pas pris en compte dans une évaluation AMDE. Bien que les fabricants de dispositifs médicaux ne puissent pas entièrement éviter ces risques, ils peuvent sensibiliser les utilisateurs aux risques résiduels liés à l'utilisation du dispositif.
Évaluation de la gravité
La norme ISO 14971 considère la gravité du risque sur la base de l'atteinte à la vie des personnes, alors que l'AMDE la considère sur la base de défaillances dans les performances du système. La gravité du risque peut être considérée comme faible dans l'AMDE s'il y a une perte de fonction mineure, même si elle peut entraîner la perte de vies humaines. La gravité sera considérée comme élevée si le dispositif tombe en panne.
Par exemple, FDA un fil-guide (classe I) destiné à être inséré dans un cathéter percutané afin de guider celui-ci à travers un vaisseau sanguin. Le revêtement du fil-guide en question risque de s'écailler. L'AMDEC a potentiellement classé ce produit comme présentant un faible risque après évaluation, mais il peut avoir de graves conséquences sur la santé du patient.
Procédure d'évaluation des risques et des modes de défaillance
L'AMDE et la norme ISO 14971 diffèrent dans la manière dont le risque est évalué. Dans l'AMDE, le risque est évalué en identifiant les modes de défaillance et les effets potentiels, puis en classant la gravité des défaillances. Chacune des causes potentielles est identifiée et la probabilité d'occurrence est déterminée. Le risque est évalué sur la base de l'indice de priorité du risque (IPR).
Cartographie de l'AMDE
Dans le cas de la cartographie de la gestion des risques conformément à la norme ISO 14971, un outil de traçabilité connu sous le nom de matrice de traçabilité des dangers (HTM) est utilisé. Il comprend l'analyse, l'évaluation et le contrôle des risques, ainsi que l'évaluation des risques résiduels.
Matrice de traçabilité des dangers
| Analyse des risques | Risque Eval. | Contrôle des risques | ||||||||||||
| ID | Risques | Séquence ou combinaison d'événements raisonnablement prévisibles | Dangereux Situation | Harm | Occurrence | Sévérité | Acceptables ? | Options de contrôle des risques et justification | Contrôle des risques Mesures | Risque Contrôle Vérification | Statut | Risque potentiel | Gravité du risque | Risque résiduel |
| 1 | Tension de ligne | L'utilisateur utilise l'appareil | L'utilisateur/patient peut être exposé à une tension électrique lorsqu'il est en contact avec le dispositif. | Décès de l'utilisateur ou du patient | 5 | 5 | N | La sécurité est assurée par une modification de la conception et des mesures de protection peuvent être mises en place. | Conception conforme à la norme IEC 61010. | Les essais électriques doivent être effectués conformément à la norme IEC 61010. | Terminé | 2 | 2 | Y |
![]()
Après avoir examiné les différences entre les deux normes, on peut conclure que la norme ISO 14971 suit une approche globale de la gestion des risques, tandis que l'AMDE est davantage un outil de fiabilité. Toutefois, les fabricants de dispositifs médicaux devraient se conformer à la norme ISO 14971 pour répondre aux attentes des autorités réglementaires en matière de normes de gestion des risques.
Pour en savoir plus sur la conformité à la norme ISO 14971:2016 et les services de conseil en gestion des risques, contactez Freyr dès aujourd'hui !









