Un « dispositif prédicat » est un dispositif médical qui a déjà été approuvé par la US and Drug Administration (FDAUS etUS est déjà commercialisé. Il sert de référence pour les nouveaux dispositifs médicaux qui font l'objet d'une demande d'autorisation via la procédure510(k) FDA.
Il doit être prouvé que le dispositif en question est au moins aussi sûr et efficace que le dispositif prédicat en termes d'utilisation prévue et de caractéristiques technologiques. Cette comparaison est connue sous le nom de "détermination de l'équivalence en substance".
Il n'est pas nécessaire qu'un nouveau dispositif soit identique au dispositif principal pour qu'il soit substantiellement équivalent à ce dernier.
Comment identifier un dispositif prédicat ?
La base de données FDAfournit un code produit à trois lettres pour chaque classification de dispositif. La base de données FDA (k) contient des informations sur tous les dispositifs autorisés dans le cadre duprocessus 510(k). Une fois que vous disposez du code produit à trois lettres, vous pouvez obtenir une liste de tous les produits, de toutes les entreprises et des noms commerciaux de tous les concurrents ou concurrents potentiels que vous souhaitez examiner. Vous pouvez ensuite effectuer une analyse et une comparaison approfondies afin de réduire le champ des dispositifs prédicats.
Vous trouverez ci-dessous un organigramme illustrant le processus d'identification et de réduction du champ des dispositifs prédicats.
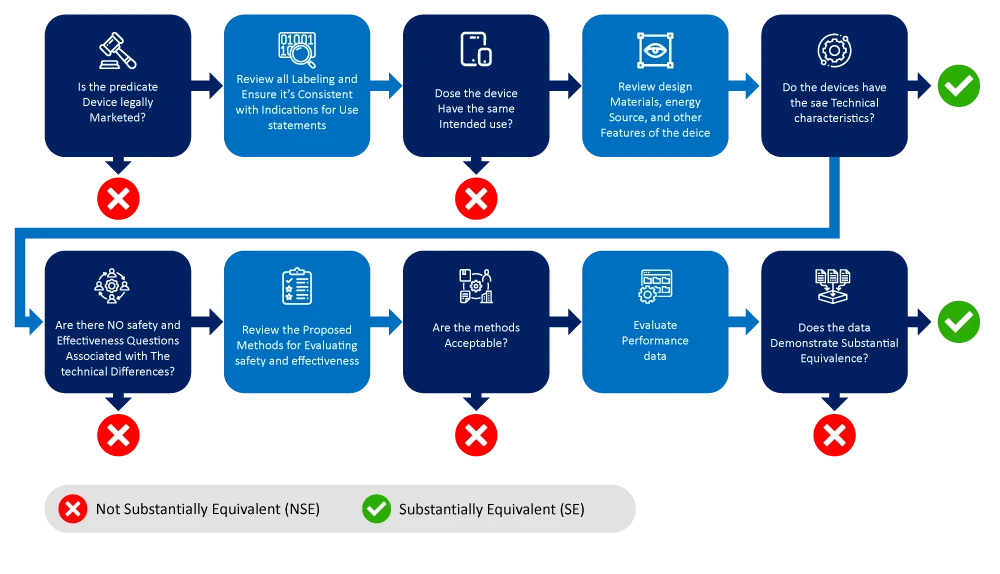
Facteurs à prendre en compte pour déterminer le(s) dispositif(s) prédicat(s)
- Utilisation prévue: L'utilisation prévue après le dispositif prédicat doit être similaire à celle du nouveau dispositif. Par exemple, si le nouveau dispositif est destiné à être utilisé pour la surveillance cardiaque, le dispositif prédicat doit également être un dispositif de surveillance cardiaque.
- Caractéristiques technologiques: Le dispositif prédictif doit être identique au nouveau dispositif en termes de caractéristiques technologiques. Par exemple, la conception, les matériaux utilisés et la méthode de fonctionnement doivent être similaires.
- Biocompatibilité: L'évaluation de la biocompatibilité d'un dispositif médical ou d'un composant ne doit pas se limiter aux matières premières utilisées dans le dispositif et le processus de fabrication, et d'autres produits chimiques doivent également être pris en compte. Ce facteur ne s'applique toutefois pas aux DIV.
- Technologie la plus récente: Le dispositif prédicat ne doit pas être obsolète et doit représenter la technologie médicale la plus récente.
Le dispositif prédicat est un facteur clé pour déterminer si un nouveau dispositif médical peut être mis sur le marché par la voie 510(k). Le choix d'un mauvais dispositif prédicat peut entraîner une procédure d'approbation réglementaire plus coûteuse et plus longue, tandis que le choix d'un bon dispositif prédicat peut contribuer à réduire le coût et le temps nécessaires à la mise sur le marché d'un nouveau dispositif médical. Si le dispositif prédicat n'est pas adapté, cela peut entraîner des retards et des dépenses supplémentaires.
Pour obtenir de l'aide concernant le processus de soumission 510(k) de votre dispositif médical, prenez rendez-vous avec les experts Freyr , qui vous aideront à vous y retrouver dans les procédures. Restez informé. Restez en conformité.









