Les autorités sanitaires de tous les pays, à l'exception du Canada, exigent que tous les fabricants étrangers de dispositifs médicaux désignent un représentant local, national ou agréé. Le représentant légal a pour mission de représenter le fabricant et le dispositif dans le pays cible et d'assurer la liaison entre les autorités sanitaires et les fabricants étrangers. Il existe un jargon spécifique à chaque pays pour désigner un représentant local. Aux États-Unis, le représentant local est appelé « US », tandis qu'au Royaume-Uni, il est appelé « UKRP » (United Kingdom Responsible Person, personne responsable au Royaume-Uni). Au Sri Lanka, le représentant local est appelé « agent local du Sri Lanka » ou « représentant autorisé du Sri Lanka », qui est également le titulaire de l'autorisation de mise sur le marché (MAH) du dispositif.
Les fabricants étrangers de dispositifs médicaux peuvent choisir de désigner leur distributeur comme agent local, qui sera également, par défaut, le Market Authorization Holder (MAH). Cependant, il est recommandé de désigner un prestataire de services tiers sans conflit d'intérêts comme MAH. Les avantages de désigner un prestataire de services tiers indépendant comme MAH sont mentionnés ci-dessous. Un MAH doit :
- Être compétent en matière d'affaires réglementaires nationales et d'exigences en matière de gestion de la production.
- Atteindre les objectifs commerciaux en désignant plusieurs distributeurs pour pénétrer le marché.
- Capacité à se concentrer sur la conformité réglementaire
- Compétence technique pour répondre aux questions posées par l'Agence
- Étiquettes communes pour un seul MAH dans l'ensemble du pays
- Évitez les subtilités liées à la mise à jour des étiquettes en cas de changement de distributeur, qui agirait également en tant que titulaire de l'autorisation de mise sur le marché/agent local.
Dans quelques pays, par exemple en Inde, il n'existe aucune disposition permettant de transférer l'autorisation de mise sur le marché et une nouvelle demande doit être soumise. En revanche, au Sri Lanka, l'autorité nationale de réglementation des médicaments (NMRA) autorise le transfert du DAMM. La principale difficulté à laquelle les fabricants de dispositifs étrangers sont confrontés lorsqu'ils changent de MAH est l'obligation de soumettre un certificat/une lettre de non-objection (NoC/NoL) de la part du MAH actif actuel. L'ARNM facilite également le transfert de DAMM, même lorsque le DAMM est réticent à délivrer un avis de conformité.
Le changement de nom et/ou d'adresse du titulaire de l'autorisation de mise sur le marché du Sri Lanka n'est pas considéré comme un transfert d'autorisation de mise sur le marché si le titulaire est la même personne/entité, et ce changement doit être notifié au moyen d'une demande de modification postérieure à l'autorisation. Le fabricant doit contacter directement l'ARNM s'il a l'intention de modifier les coordonnées du titulaire de l'AMM figurant dans la demande, qui est encore en cours d'examen par l'ARNM.
L'obligation de transférer un DAMM découle de scénarios dans lesquels le fabricant décide de se défaire de l'autorisation de mise sur le marché en cours ou lorsque l'autorisation de mise sur le marché en cours est reprise par une autre entité juridique. Le DAMM à transférer est appelé le cédant et la société, le partenariat commercial, la personne physique ou morale à qui le transfert doit être accordé est appelé le cessionnaire.
Pour que la procédure de transfert de MAH soit lancée, le cédant doit émettre une lettre de non-objection (NOL) en accord avec le transfert. Si le cédant refuse d'émettre la lettre de non-objection, l'autorité accorde un délai de 14 jours pour présenter une objection à la désignation du cessionnaire (nouveau détenteur d'une AMM). Si la raison de l'objection est valable et concerne le fabricant, l'autorité informe le fabricant de résoudre l'objection et poursuit la procédure de transfert. Si le cédant a un conflit commercial avec le cessionnaire ou le fabricant, l'ARNM poursuit la procédure de transfert car l'autorité se préoccupe de la disponibilité des dispositifs sur le marché sri-lankais plutôt que d'obligations commerciales entre les différentes parties prenantes.
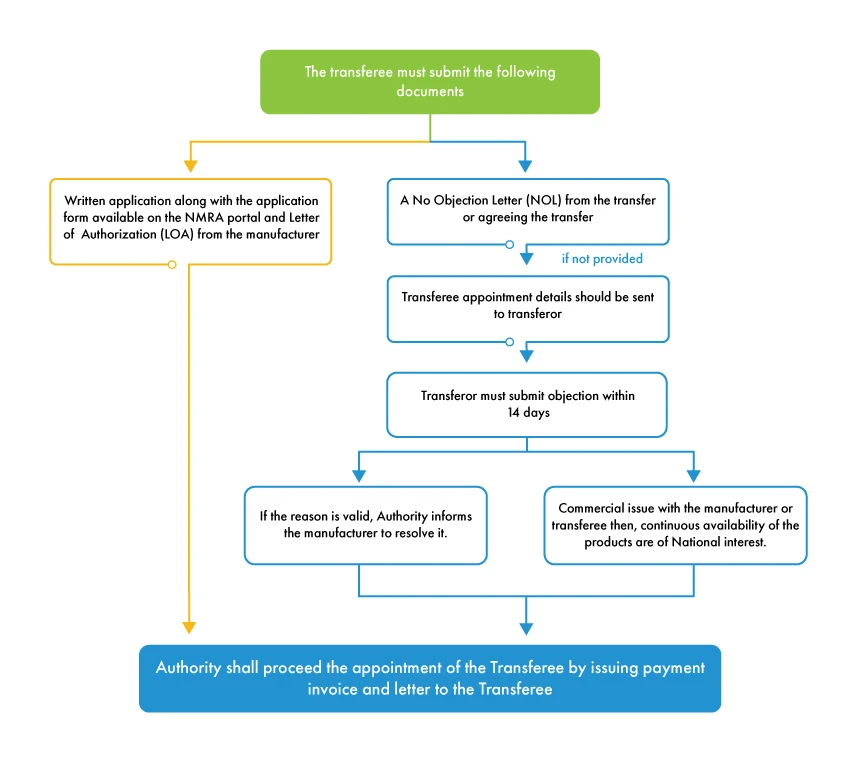
Contrairement à ce qui se passe dans d'autres pays, la réglementation de l'ARNM est favorable aux fabricants étrangers en ce qui concerne le transfert de MAH. L'ARNM autorise le transfert du MAH avec tous les documents requis, à moins que l'objection soulevée par le cédant ne soit substantielle et réelle. Tous les fabricants étrangers ont intérêt à désigner un MAH indépendant pour éviter toute complication dans le processus d'autorisation de mise sur le marché de leurs produits au Sri Lanka. L'assistance de l'agent local pour les dispositifs médicaux au Sri Lanka sert de plateforme à tous les fabricants étrangers pour nommer et changer le MAH de manière transparente avec la documentation appropriée.
Pour les services d'agent local/MAH ou pour les services de transfert MAH au Sri Lanka, reach un expert régional en réglementation. Restez informé. Restez en conformité.









