
Quel est le rôle de la cybersécurité dans les dispositifs médicaux ?
Le processus d'autorisation 510(k)est une procédure réglementaire utilisée par la Food and Drug Administration (FDAUS pour évaluer et autoriser la commercialisation des dispositifs médicaux. Ce processus vise à garantir que les dispositifs médicaux sont sûrs et efficaces pour les patients.FDA US FDA la cybersécurité comme « le processus visant à empêcher l'accès non autorisé, la modification, l'utilisation abusive ou le refus d'utilisation, ou l'utilisation non autorisée d'informations stockées, consultées ou transférées d'un dispositif médical vers un destinataire externe ».
Les dispositifs médicaux sont de plus en plus connectés à des réseaux et sont donc vulnérables aux menaces de cybersécurité telles que le piratage, les violations de données et les attaques de logiciels malveillants. Il est essentiel d'aborder la cybersécurité au stade de la conception et du développement afin de garantir que les dispositifs médicaux disposent de contrôles de sécurité appropriés. Les menaces et les vulnérabilités ne peuvent être éliminées, et la réduction des risques de cybersécurité est particulièrement difficile. Si la cybersécurité n'est pas maintenue correctement, elle pourrait compromettre la fonctionnalité des dispositifs, entraîner la perte de données personnelles ou médicales et permettre aux menaces de sécurité de se propager à d'autres réseaux ou dispositifs interconnectés.
Incidents dus à une cybersécurité compromise
Les incidents liés à la cybersécurité ont rendu inopérants des appareils médicaux et des réseaux hospitaliers, perturbant ainsi la prestation des soins aux patients dans les établissements de santé aux US. Ces cyberattaques et exploits peuvent également nuire aux patients en raison des risques cliniques qu'ils entraînent, par exemple un retard dans le diagnostic et/ou le traitement des patients.
Voici une liste des principaux incidents survenus dans le secteur des soins de santé qui soulignent l'importance de la cybersécurité pour la sécurité des patients.
- En 2017, l'attaque du ransomware WannaCry a touché des systèmes hospitaliers et des dispositifs médicaux dans le monde entier.
- En 2020, une attaque de ransomware contre un hôpital allemand a mis en évidence les quatre-vingt-trois (83) conséquences potentielles d'un retard dans la prise en charge des patients, qui ont dû être transférés vers un autre hôpital.
Les principales considérations en matière de cybersécurité pour l'autorisation 510(k)
Voici les principes généraux de cybersécurité pour les fabricants de dispositifs médicaux, selon les directivesFDA US spécifiques aux demandes préalables à la mise sur le marché.
- Réglementation relative au système qualité (QSR):les fabricants doivent traiter les questions de cybersécurité dès la phase de conception et de développement des dispositifs médicaux, car cela permet de réduire de manière plus efficace et plus robuste les risques pour les patients. Les fabricants doivent définir des spécifications de conception liées à la cybersécurité pour leurs dispositifs, ainsi qu'une approche de gestion des vulnérabilités en matière de cybersécurité dans le cadre de la validation des logiciels et de l'analyse des risques requises par 21 CFR 820.30(g).
- Sécurité de conception :les fabricants d'appareils doivent s'assurer que leurs produits sont conçus dans le respect des normes de sécurité. LaFDA US FDA l'adéquation de la sécurité en fonction de la capacité de l'appareil à fournir et à mettre en œuvre des objectifs de sécurité tels que l'authenticité, l'autorisation, la disponibilité, la confidentialité et la sécurité, ainsi que la possibilité de mise à jour rapide dans toute l'architecture du système.
- Transparence: Le manque d'informations sur la cybersécurité du dispositif, telles que les informations nécessaires pour intégrer le dispositif dans l'environnement d'utilisation, ainsi que les informations dont les utilisateurs ont besoin pour maintenir la cybersécurité tout au long du cycle de vie du dispositif, peut avoir une incidence sur la sécurité et l'efficacité de ce dernier. Pour répondre à ces préoccupations, il est important que les utilisateurs de dispositifs aient accès aux informations relatives aux contrôles de cybersécurité, aux risques potentiels et à d'autres informations pertinentes.
- Documentation de la demande : La conception et la documentation relatives à la cybersécurité des dispositifs sont censées s'adapter au risque de cybersécurité d'un dispositif. Les fabricants doivent tenir compte du système plus large dans lequel un dispositif peut être utilisé.
Figure 1 : Défis et solutions communs en matière de cybersécurité 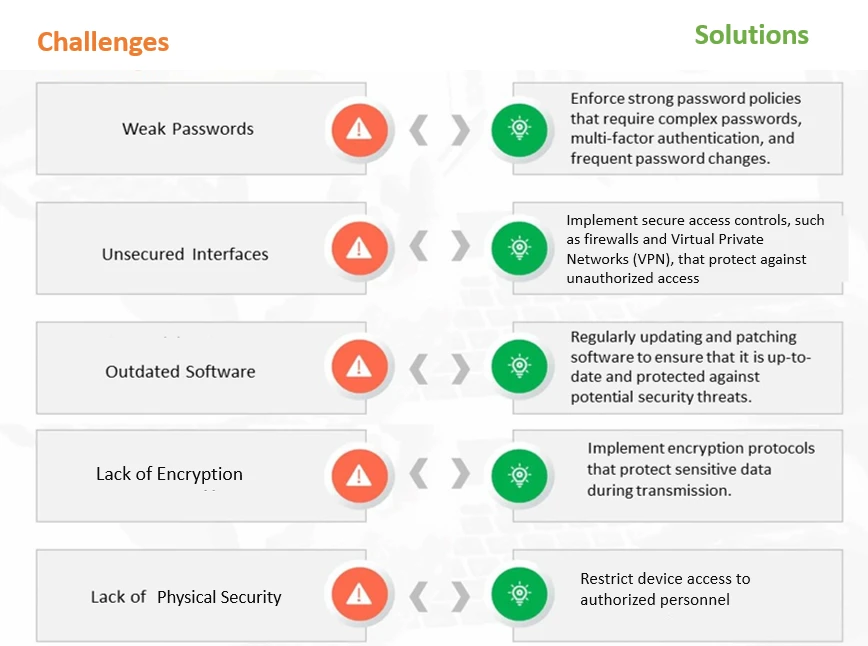
Conclusion
En résumé, la cybersécurité des dispositifs médicaux est essentielle pour garantir la sécurité des patients et prévenir les incidents susceptibles de perturber la prestation des soins de santé. Les réglementationsFDA US FDA soulignent la nécessité pour les fabricants de traiter les questions de cybersécurité lors de la conception et du développement des dispositifs médicaux et de fournir des informations transparentes sur les contrôles de cybersécurité. Le QSR, la sécurité de la conception, la transparence et la documentation soumise sont des éléments clés à prendre en compte pour l'autorisation 510(k). Il est également important de relever les défis courants en matière de cybersécurité, tels que les vulnérabilités des composants tiers et les attaques par ransomware, et de mettre en œuvre des solutions telles qu'une analyse robuste des risques et des mises à jour régulières des logiciels.
Pour bénéficier d'un processus d'autorisation 510(k) sans problème et conforme, contactez nos experts en réglementation. Restez informé ! Restez en conformité !









