
Dans la perspective d'une traçabilité globale des dispositifs, le ministère sud-coréen de la sécurité alimentaire et des médicaments (MFDS) a suggéré/mandaté ? une nouvelle exigence réglementaire pour l'incorporation du système d'identification unique des dispositifs (UDI) sur les dispositifs médicaux. L'enregistrement des dispositifs médicaux et l'UDI sont des procédures intégrées, et l'UDI est une condition préalable à l'établissement de dispositifs médicaux sur le marché coréen. Pour garantir la sécurité des patients, le MFDS a introduit en 2016 le système intégré d'information sur les dispositifs médicaux (IMDIS), une plateforme destinée à réglementer la traçabilité des dispositifs médicaux en Corée du Sud.
Selon l'article 2 de la loi sur les dispositifs médicaux (Medical Device Act) spécifiant les réglementations relatives aux dispositifs médicaux UDI, un système UDI comprend les numéros et les codes-barres indiqués sur le contenant et l'emballage, etc. des dispositifs médicaux dans un système normalisé afin de les identifier et de les gérer de manière complète et efficace. Le MFDS attend des fabricants qu'ils enregistrent les informations dans la plateforme IMDIS. IMDIS est utilisé pour relier électroniquement le système d'information relatif aux dispositifs médicaux.

Source : Easy Medical Device
L'UDI consiste en un code-barres lisible par une machine qui comprend :
- Identifiant du dispositif - une combinaison de chiffres ou d'alphabets générée de manière unique pour chaque produit dans l'UDI.
- Identifiant du produit - une combinaison de chiffres ou de lettres générée par l'unité de production dans l'UDI. Il comprend le numéro de fabrication (lot, numéro de série), la date de production et les informations sur la version du produit.
Délais d'intégration des exigences UDI dans l'emballage des dispositifs médicaux :
Dans le cadre de la révision de la loi sur les dispositifs médicaux en 2016, le système IMDIS a été introduit pour comprendre et effectuer un traçage systématique des dispositifs. Après la mise en œuvre réussie de la plateforme IMDIS, l'incorporation de l'UDI dans l'emballage s'est faite de manière progressive, l'UDI étant rendu obligatoire comme le montre l'illustration ci-dessous.
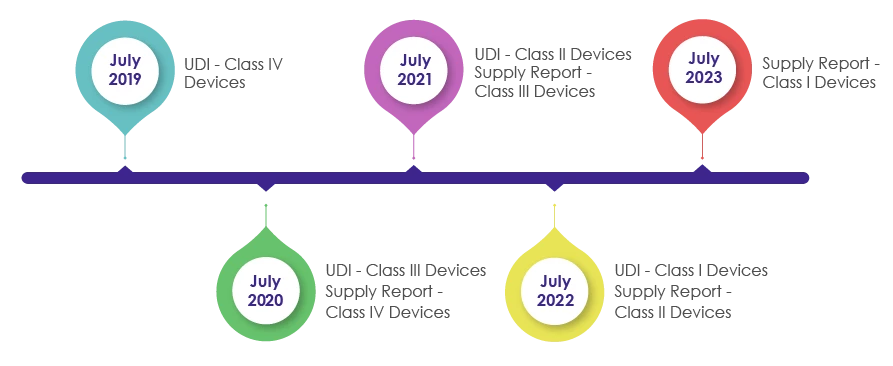
Le MFDS exige des fabricants, des vendeurs et des fournisseurs de dispositifs médicaux qu'ils enregistrent les données relatives aux dispositifs fournis et qu'ils fournissent les informations relatives à la fourniture (qui comprennent le fournisseur, le numéro de lot, l'unité d'emballage, la quantité, la date, le prix unitaire et le prix de vente) dans le rapport de fourniture de l'UDI.
Processus de création d'un UDI :
Les fabricants ou importateurs de dispositifs médicaux attribuent une UDI à leurs dispositifs par nom de modèle et unité de conditionnement conformément à l'article 3, paragraphe 2, avant d'expédier des dispositifs médicaux autorisés, certifiés ou déclarés. Lorsque l'UDI est marquée sous la forme d'un code-barres, le système international normalisé GS1 doit être utilisé. Pour l'UDI-DI, un code GTIN (Global Trade Item Number) doit être utilisé, tandis que pour l'UDI-PI, des identificateurs d'application GS1 (AI) doivent être utilisés.
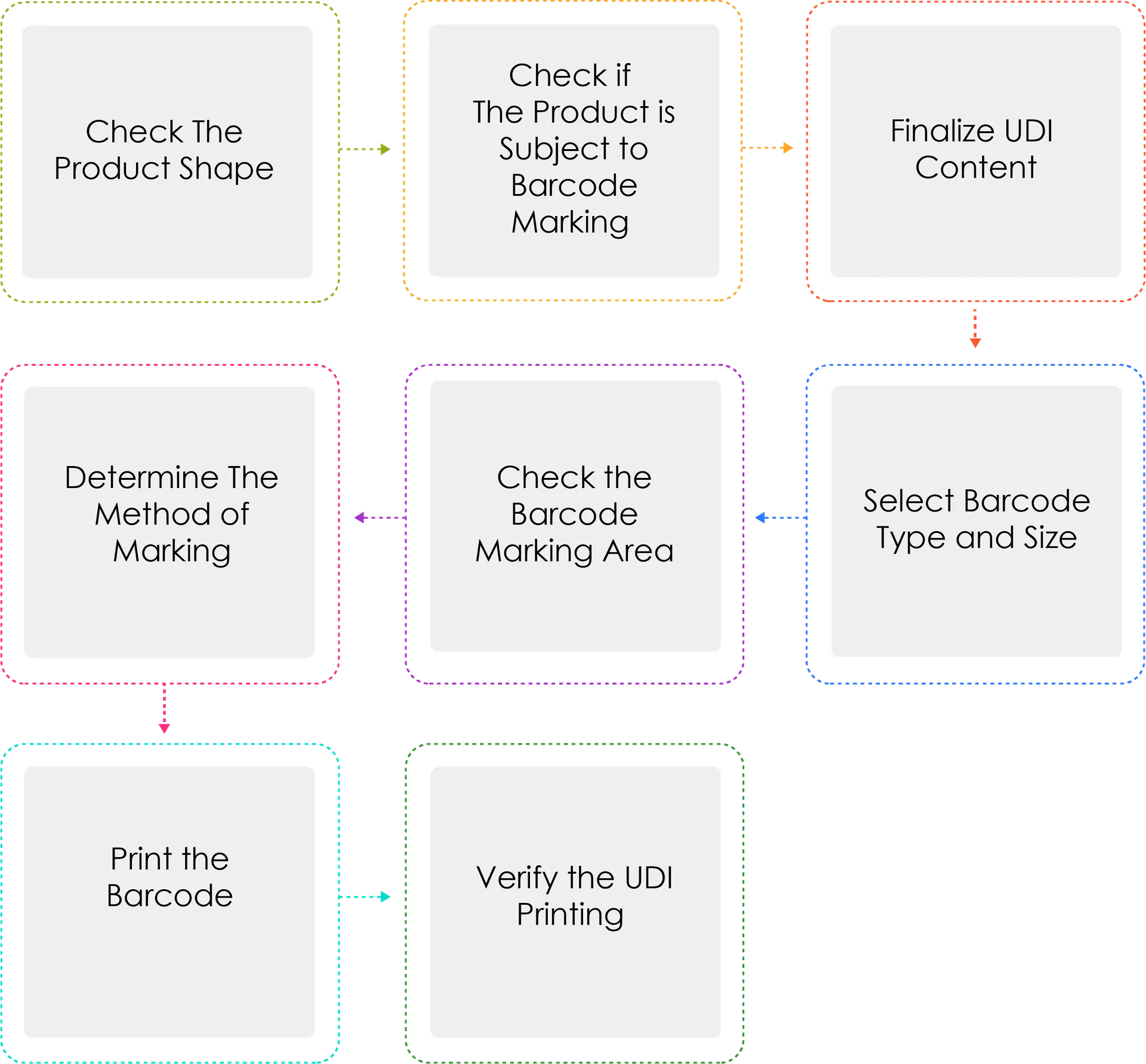
Pourquoi Determine, la méthode de notation, est-elle écrite trois fois ?
Grâce à la mise en œuvre des exigences de conformité de l'UDI, le MFDS peut rationaliser les activités préalables à la mise sur le marché (c'est-à-dire la conformité du système de gestion de la qualité, l'évaluation des essais cliniques et l'approbation générale) ainsi que les activités postérieures à la mise sur le marché (c'est-à-dire les rapports sur les effets indésirables, les rappels) des dispositifs. La tentative consciente du MFDS de tracer et de contrôler les dispositifs garantira la sécurité et l'efficacité des dispositifs sur le marché sud-coréen.
Pour en savoir plus sur la conformité UDI et le processus d'enregistrement des dispositifs médicaux en Corée du Sud, reach Freyr.









