
Quality Management System (QMS) un élément essentiel de l'industrie des dispositifs médicaux, garantissant la sécurité, l'efficacité et la conformité réglementaire des dispositifs médicaux tout au long de leur cycle de vie. Le SGQ est mis en œuvre à toutes les étapes du cycle de vie des dispositifs médicaux, y compris la phase de conception et de développement, afin de garantir que le dispositif répond aux exigences réglementaires et aux besoins des utilisateurs, et que tous les risques potentiels sont identifiés et traités.
Figure 1 - Étapes du cycle de vie des dispositifs médicaux
Dans ce blog, nous aborderons l'importance du SMQ dans la phase de conception et de développement du cycle de vie des dispositifs médicaux.
Phase de conception et de développement dans le cycle de vie des dispositifs médicaux
La phase de conception et de développement est l'une des étapes les plus critiques du cycle de vie d'un dispositif médical. Au cours de cette étape, la conception du dispositif est développée et des prototypes sont créés, suivis de tests de vérification et de validation dans le cadre du cycle de vie du dispositif médical.
Afin de garantir que le dispositif médical répond aux exigences réglementaires, aux critères de sécurité et d'efficacité, et aux attentes des utilisateurs, la mise en œuvre d'un Quality Management System (QMS) est essentielle dès la phase de conception et de développement du cycle de vie d'un dispositif médical.
La documentation est cruciale pendant la phase de conception et de développement des dispositifs médicaux. Le système de gestion de la qualité garantit que toute la documentation relative à la conception et au développement est contrôlée, gérée et documentée.
Le Design History File (DHF) un dossier/registre important qui contient toute la documentation relative à la conception et au développement du dispositif. Le DHF fournit la preuve que la conception du dispositif est conforme aux exigences réglementaires.
Le DHF doit contenir la documentation relative aux intrants et aux extrants de la conception, aux revues de conception, à la vérification et à la validation de la conception, aux modifications apportées à la conception et à la gestion des risques. Pour en savoir plus sur le DHF, cliquez ici.
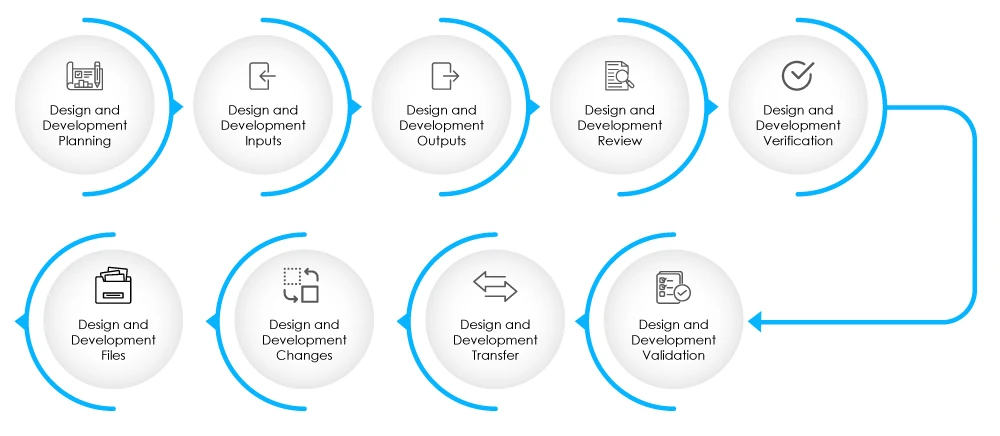
Fig 2 - Étapes de la phase de conception et de développement
Bonnes pratiques pour la phase de conception et de développement
- Établir une approche structurée: Élaborer une approche structurée du développement et de la gestion du DHF, adaptée aux besoins spécifiques de votre organisation. Cette approche doit comprendre des lignes directrices, des procédures et des flux de travail clairs pour le développement et la gestion du DHF.
- Définir et documenter les données de conception: Définir et documenter clairement les données de conception, y compris les exigences et les spécifications du dispositif. Cela permet de s'assurer que le cadre de référence de la conception est complet et exhaustif.
- Gérer les modifications de conception: Mettre en œuvre un processus solide de gestion des modifications qui comprend des procédures de documentation, d'évaluation et d'approbation des modifications de conception. Cela permet de s'assurer que les modifications sont correctement documentées et évaluées en fonction de leur impact sur la sécurité et l'efficacité du dispositif.
- Assurer la traçabilité: Élaborer une matrice de traçabilité qui relie les éléments de conception aux résultats de la conception et veiller à ce que toutes les activités de conception et de développement soient correctement documentées et enregistrées. Cela peut contribuer à garantir la traçabilité du cadre de référence de la conception et à faire en sorte que le processus de prise de décision soit bien documenté.
- Équilibrer l'innovation et la conformité: Développer une culture de l'innovation tout en veillant à ce que les exigences de conformité liées à la DHF, telles que les contrôles de conception et la gestion des risques, soient respectées. Pour ce faire, il convient d'élaborer des procédures et des flux de travail qui facilitent l'innovation tout en garantissant le respect des exigences réglementaires.
- Mettre en œuvre le contrôle des documents: Mettre en œuvre des procédures de contrôle des documents qui garantissent que les documents du DHF sont correctement contrôlés, que leurs versions sont contrôlées et qu'ils sont accessibles au personnel autorisé. Cela permet de s'assurer que les documents DHF sont sécurisés et que les modifications sont correctement documentées et approuvées.
- Former l'équipe: Veiller à ce que l'équipe chargée du développement et de la gestion du DHF soit correctement formée aux exigences du DHF et dispose de l'expertise technique nécessaire pour développer le produit. Cet objectif peut être atteint grâce à des sessions de formation régulières, au mentorat et à l'embauche de professionnels expérimentés possédant les compétences et l'expertise nécessaires.
En suivant ces bonnes pratiques, l'industrie des dispositifs médicaux peut garantir la conformité aux exigences réglementaires, promouvoir la sécurité et l'efficacité de ses produits et maintenir son avantage concurrentiel sur le marché.
En conclusion, la mise en œuvre d'un système de gestion de la qualité dès la phase de conception et de développement est essentielle pour réussir dans le secteur très réglementé des dispositifs médicaux. En conservant des enregistrements systématiques et en répondant aux exigences réglementaires, l'industrie des dispositifs médicaux peut s'assurer qu'elle fournit des produits de haute qualité et qu'elle maintient la satisfaction de ses clients.
Chez Freyr, nous proposons des services QMS pour aider l'industrie des dispositifs médicaux à répondre aux exigences réglementaires à toutes les étapes du cycle de vie des dispositifs médicaux.Contacteznos experts QMS et réglementaires pour en savoir plus.









