
Une notification 510(k) ou une notification préalable à la mise sur le marché est une demande soumise à la Food and Drug Administration (FDAUS afin de démontrer que le dispositif destiné à être commercialisé est sûr et efficace, c'est-à-dire qu'il est substantiellement équivalent à un dispositif déjà commercialisé légalement ou à un dispositif de référence. Voici les trois (03) types de notifications 510(k) qu'un fabricant de dispositifs médicaux peut soumettre :
- Traditionnel
- Abrégé
- 510(k) spécial
Dans cet article, nous examinerons les cas dans lesquels votre demande serait éligible au deuxième type, une procédure 510(k) abrégée, conformément auxFDA US .
Une demande 510(k) abrégée est utilisée pour démontrer l'équivalence substantielle à une norme, un contrôle spécial ou une directive reconnus à l'aide d'une déclaration de conformité (DoC). Dans une demande abrégée, les fabricants démontrent l'équivalence substantielle aux normes reconnues en se basant sur l'utilisation de documents d'orientation ou de DoC, plutôt que sur un dispositif de référence, afin de faciliter l'examenFDA US . Vous trouverez ci-dessous l'organigramme permettant de déterminer l'équivalence substantielle pour une demande abrégée 510(k).
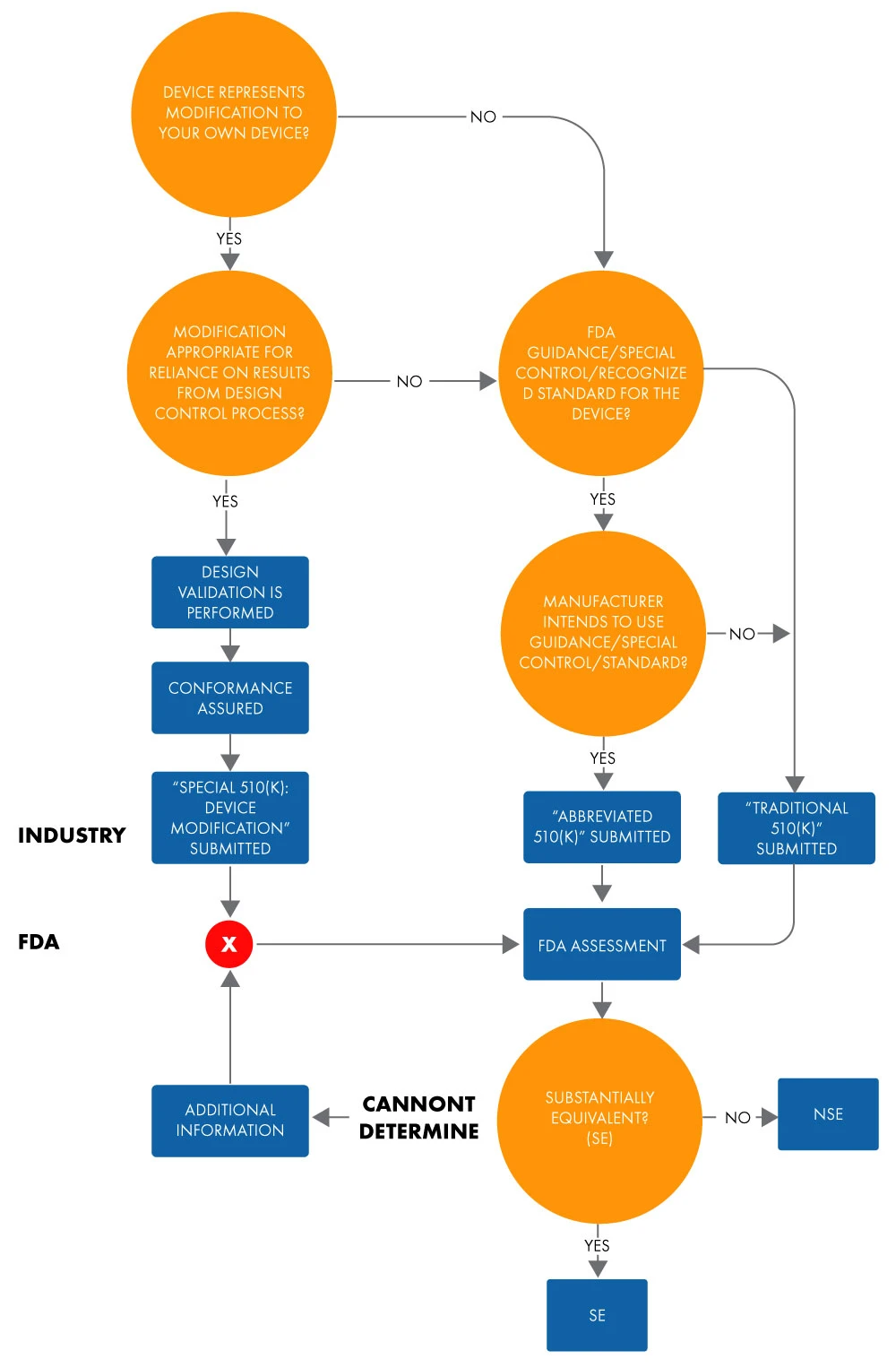
Figure 1 : Intention de mise sur le marché d'un dispositif via 510(k)
Le terme "abrégé" suggère que ce type de procédure d'approbation 510(k) est plus court. Or, ce n'est pas tout à fait vrai. Elle prend autant de temps qu'une approbation 510(k) traditionnelle. Il en va de même pour la documentation et les coûts. En outre, le format des 510(k) traditionnels et abrégés, en termes de chapitres et de structure, est similaire.
Lors de la soumission d'un 510(k) abrégé, vous devez vous appuyer sur les éléments identifiés dans le 21 CFR 807.87 (soumissions 510[k] traditionnelles). Vous pouvez choisir de soumettre un 510(k) abrégé lorsque la soumission repose sur les éléments suivants :
- Document(s)FDA : lors dela soumission d'une demande 510(k) abrégée, vous devez inclure un rapport sommaire décrivant le respect du document d'orientation pertinent et la manière dont il a été utilisé lors du développement et des essais du dispositif.
- Démonstration de la conformité aux contrôles spéciaux pour le type de dispositif : vousdevez vous conformer à des contrôles spéciaux tels que les normes de performance, la surveillance post-commercialisation (PMS), les registres de patients, l'élaboration et la diffusion de lignes directrices, de recommandations, etc., qui fournissent une assurance raisonnable de la sécurité et de l'efficacité du dispositif. Une demande 510(k) abrégée qui s'appuie sur un ou plusieurs contrôles spéciaux doit inclure les éléments suivants. Un rapport sommaire décrivant le respect des contrôles spéciaux et la manière dont ils ont été utilisés pendant le développement et les essais du dispositif.
- La manière dont les contrôles spéciaux ont été utilisés pour faire face à un risque ou à un problème spécifique.
- Informations décrivant tout écart par rapport aux contrôles spécifiques et les efforts déployés par le fabricant pour s'y conformer.
- Norme(s) consensuelle(s) volontaire(s) : Vous êtes tenu de fournir une DoC à la norme reconnue pour une demande abrégée 510(k) qui s'appuie sur elle. Une DoC doit comprendre les éléments suivants :
- Le nom et l'adresse du demandeur/promoteur responsable de la déclaration de conformité.
- Détails de l'identification du produit/appareil, y compris les codes de produit, le nom de commercialisation de l'appareil, le numéro de modèle et toute autre donnée d'identification unique du produit spécifique à la DoC en question.
- Une déclaration de conformité.
- Une liste des normes pour lesquelles la DoC est applicable, y compris la ou les options choisies pour chaque norme, le cas échéant.
- NuméroFDA deFDA US pour chaque norme.
- La date et le lieu de délivrance de la DoC.
- La signature, le nom en caractères d'imprimerie et la fonction du sponsor responsable de la DoC.
- Toute limitation de la validité de la déclaration de conformité (par exemple, la durée de validité de la déclaration, ce qui a été testé, les concessions faites sur les résultats des tests, etc.
En conclusion, un 510(k) abrégé est un moyen utile pour les fabricants de dispositifs de démontrer l'équivalence substantielle à des normes reconnues ou à des contrôles spéciaux à l'aide d'une DoC. Pour bénéficier d'un 510(k) abrégé, les fabricants de dispositifs doivent fournir un rapport de synthèse expliquant leur adhésion aux documents d'orientation pertinents, démontrer la conformité aux contrôles spéciaux et fournir des DoC aux normes reconnues. Il est toutefois important de noter que la procédure d'approbation, la documentation et le coût d'un 510(k) abrégé sont similaires à ceux d'un 510(k) traditionnel.
Votre dispositif médical est-il éligible à une demande 510(k) abrégée ? Pour obtenir de l'aide dans le cadre du dépôt de votre demande 510(k) abrégée, reach notreexpert en réglementation. Restez informé ! Restez en conformité !









